AI播客,快速了解:
近日,浙江大学、南湖脑机交叉研究院的科研团队在神经工程领域取得重要突破,研发出一种基于激光辅助技术的单片多模态神经探针。该探针通过在光纤表面原位制备金纳米颗粒(AuNP)电极阵列,成功解决了传统神经探针机械刚性强、信号稳定性差、生物相容性不足等长期困扰业界的难题,可在小鼠脑内实现长达16周的光遗传刺激与电信号同步记录,为帕金森病、癫痫和慢性疼痛等神经系统疾病的研究与治疗提供了全新工具。该研究9月26日发表于《Science Advances》期刊上。
用于调控神经环路活动的光刺激与同步电记录 @Sci. Adv.
在神经科学研究与临床治疗中,兼具光学刺激与电信号记录功能的双模态神经探针是解析神经环路机制的核心工具。然而传统探针多采用"附加式"制备策略,通过喷墨打印、纳米压印等技术将电极贴附于载体表面,不仅电极与基底结合松散,还存在机械性能与脑组织不匹配的问题——刚性电极易随大脑活动造成组织损伤,柔性电极又难以实现精准植入。更关键的是,传统铂电极阻抗通常高达数十万欧姆,信号采集效率低,且长期植入易引发胶质瘢痕,导致记录功能在数周内失效。
针对这些痛点,科研团队创新采用“激光原位还原”技术,在直径500μm的商用光遗传光纤表面构建了嵌入式金纳米颗粒电极阵列。制备过程中,研究人员先将SU-8聚合物与聚醚胺混合涂层涂覆于光纤表面,经烘烤交联形成稳定基质;随后将光纤浸泡于氯金酸溶液中,通过355nm皮秒激光以5mm/s的速度扫描,瞬间将溶液中的金离子还原为金纳米颗粒并融合成导电电极,最后用SU-8封装形成完整探针。这种单片集成工艺让电极与光纤基底紧密结合,从根本上解决了"附加式"探针的结构稳定性问题。

金纳米颗粒(AuNP)光纤探针 @Sci. Adv.
性能测试数据显示,该新型探针展现出卓越的综合性能。在电学方面,其1kHz频率下的起始阻抗仅约600Ω,较商用铂电极降低两个数量级,8个通道阻抗一致性良好,范围在524.6至640.8Ω之间。经过20次循环伏安测试未检测到残留金离子,确保了生物安全性;在生理盐水中浸泡16周后,信号幅度仅下降15%,阻抗仅升高一个数量级。机械性能上,探针在60°弯曲(半径约0.96cm)100次后,阻抗仍低于800Ω,无显著变化,可适配脑组织随呼吸、心跳产生的动态活动。光学传输方面,480至632nm波长的光信号通过时无明显损耗,满足光遗传刺激需求。
在小鼠体内实验中,该探针的长期稳定性与生物相容性得到充分验证。科研人员将探针植入小鼠大脑上丘区域,注射光敏感病毒后,用473nm激光(功率5-15mW、脉宽1-10ms)进行刺激,连续16周稳定记录到清晰的光诱发电位,8个通道信号一致性高。免疫组化分析显示,植入4周和10周后,探针周围星形胶质细胞(GFAP标记)和小胶质细胞(Iba1标记)的表达水平显著低于商用铂电极,证明其引发的免疫反应更弱,能有效减少胶质瘢痕形成。
为进一步提升性能,团队还探索了优化路径:采用10飞秒激光替代纳秒激光制备电极,利用其更小的热扩散范围,可获得边缘更清晰、线宽更窄的电极,提升信号空间分辨率;通过SU-8隔离层实现多层电极集成,在不增加光纤直径的前提下提高通道密度。
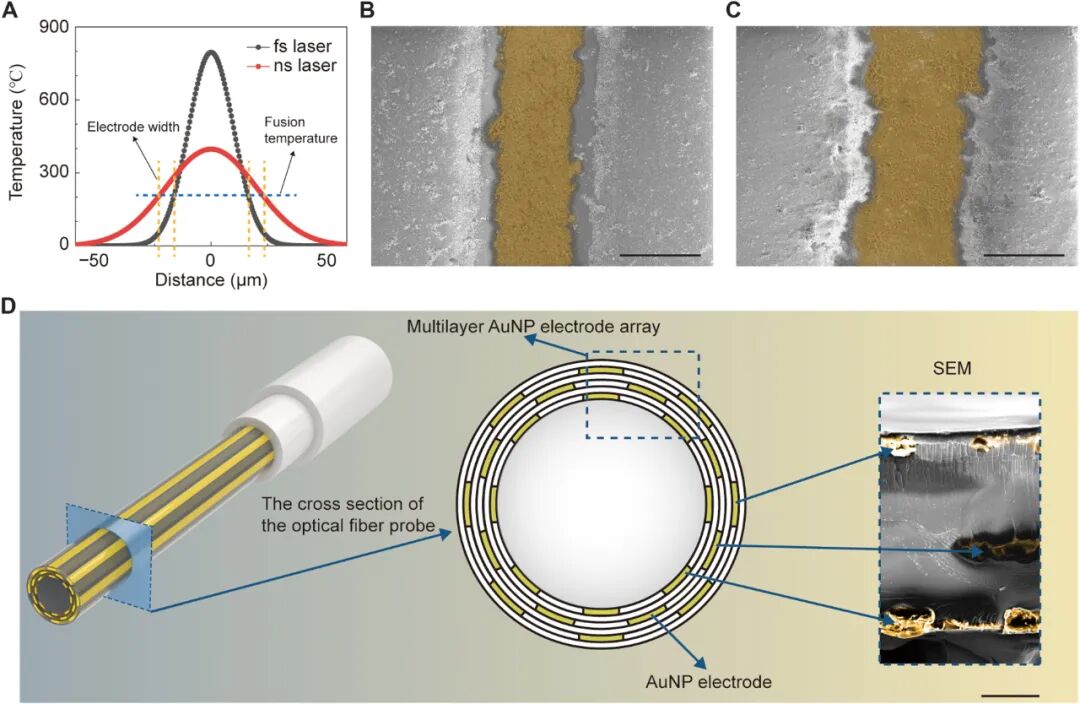
AuNP光纤探针的工艺优化 @Sci. Adv.
综上,该研究首次实现了光纤曲面金纳米颗粒电极的单片集成,突破了传统制备技术的多维度缺陷。其长达16周的稳定工作能力,为神经环路动态过程研究提供了高时空分辨率工具;而优异的生物相容性与双模态功能,更让其在帕金森病、癫痫等神经系统疾病的精准光遗传治疗中展现出巨大临床潜力,有望推动脑机接口技术从基础研究向临床转化迈出关键一步。
*本文基于研究《Monolithic multimodal neural probes for sustained stimulation and long-term neural recording》的部分内容,视频图片来自研究论文;本文仅用作学术分享,如有侵权请告知删除。
研究团队如下:

参考:
https://doi.org/10.1126/sciadv.adu1753

