复旦大学附属华山医院神经外科毛颖&陈亮课题组、中国科学院大学、上海市脑虎科技公司联合在中科院1区《Advanced Science》上发表题为:“Chronically Stable, High‐Resolution Micro‐Electrocorticographic Brain‐Computer Interfaces for Real‐Time Motor Decoding”的文章。该研究提出了一种基于柔性高密度μECoG电极阵列的高分辨率微皮层电图(μECoG)脑机接口(BCI),能够实现长期稳定且实时的运动解码。利用微纳米制造技术,μECoG BCI的电极密度比传统临床电极阵列提高了64倍,提升空间分辨率并具备可扩展性。研究结果表明,µECoG BCI在无需皮层内侵入的情况下,达到了与皮层内脑电(iEEG)BCI相当的性能,标志着柔性脑机接口临床可行性取得重要突破。

01
背景
脑信号采集是脑机接口性能的核心,目前主要有三种技术路径:脑电图(EEG)通过头皮记录,虽然无创易用,但信号在穿越脑膜、颅骨、头皮时严重衰减,空间分辨率低、信噪比差,通常只能完成简单有延迟的解码任务;皮层内脑电图(iEEG)将微电极阵列植入大脑皮层内部,具有最高的时空分辨率(可达单神经元、亚毫秒级),但侵入性创伤大、大脑覆盖范围有限,长期稳定性面临挑战;皮层脑电图(ECoG)将电极阵列放置于大脑皮层表面,在信号质量与侵入性之间取得最佳平衡,空间分辨率和信噪比显著优于EEG,且大脑覆盖更广,已展现出解码复杂运动与言语的潜力。传统ECoG受限于制造工艺,电极密度和通道数有限,制约了高精度解码的发展,而微皮层脑电图(μECoG)利用微纳制造技术,实现高密度、柔性电极阵列,在保持ECoG微创优势的同时大幅提升空间分辨率与通道数,为开发高性能、临床可行的脑机接口提供了新的技术路径。
02
方法学
2.1 μECoG电极阵列制造与集成
采用微纳加工技术制造高密度柔性μECoG电极阵列,该阵列包含16×16(共256)个直径为850微米的记录点(间距1250微米),并以三层柔性聚酰亚胺(PI)层夹嵌金质触点。阵列与柔性印刷电路(FPC)连接,并通过集成了四颗Intan RHD2164芯片的信号处理单元进行信号放大与模数转换。整个系统最终封装于定制化的钛合金外壳内,以实现生物兼容性和长期稳定性。
2.2 动物与人体实验设计
长期动物实验:在拉布拉多犬中进行为期203天的体内植入实验,通过绑定的惯性测量单元(IMU)与视频动作捕捉系统(DeepLabCut)同步记录其运动学数据,以验证系统的长期稳定性和解码性能。
短期人体实验:招募了因临床需要(肿瘤切除或癫痫监测)而进行开颅手术的患者。在获得伦理批准和患者知情同意后,分别在术中(设计乒乓球和贪吃蛇游戏)和短期植入期(设计中心外和网格目标任务)进行实时运动意图的解码与控制实验。
2.3 神经信号记录与处理
所有μECoG信号以4000 Hz采样率记录。预处理流程包括:剔除高阻抗(>1 MΩ)通道、50 Hz工频陷波滤波、公共平均参考以消除共模噪声。信号经带通滤波和下采样至500 Hz后,分割为100毫秒的时间窗,并计算每个窗内高频伽马(HG,70-150 Hz)频段的功率谱密度(PSD)平均值,作为解码的运动特征。
2.4 运动解码算法
运动执行解码(动物):采用三层长短期记忆(LSTM)循环神经网络。输入为所有通道的HG-PSD特征,输出为三维运动轨迹。使用预测轨迹与实际轨迹间的皮尔逊相关系数作为主要性能指标。
运动想象解码(人体):采用位置-速度卡尔曼滤波器。解码目标是控制屏幕光标移动至指定目标。性能以信息传输率(比特率,BPS)进行量化。
2.5 贡献度分析与组织学检验
采用基于随机森林模型的特征重要性排序方法,评估不同脑区电极对解码任务的贡献。实验结束后,对动物脑组织进行免疫组化分析(H&E染色及GFAP、Iba-1、NeuN特异性染色),以评估植入物的生物相容性和组织反应。
03
结果
3.1 高分辨率μECoG BCI系统概述与长期性能
本研究开发的高分辨率μECoG BCI系统采用集成植入体采集高时空分辨率μECoG信号,通过提取高伽马(HG)波段功率谱密度(PSD)作为特征,利用LSTM神经解码器和位置速度卡尔曼滤波器实现运动轨迹预测。系统采用云-边端架构,边缘设备处理原始数据,高性能服务器负责模型训练和神经解码计算。经过5-7分钟重新校准即可实现实时运动解码,运动想象解码约需30分钟训练即可实现完全自主光标控制。
在为期203天的长期动物实验中,μECoG电极产率仅下降5.49%,电极阻抗和信噪比(>20 dB)保持稳定。解码性能表现优异:X方向相关系数0.87,Y方向0.90,Z方向0.83,速度0.82,且性能稳定性高(标准差0.02-0.06)。免疫组化分析显示,植入区域与对照区域在神经元数量、星形胶质细胞和小胶质细胞增殖方面无显著差异,验证了系统的生物安全性。

图1、高分辨率μECoG BCI的概述及长期性能。a)基于μECoG BCI的实时电机解码和电机图像解码的示意图和工作流程。b)μECoG BCI的集成植入体(比例杆为1厘米)。内嵌显示了μECoG电极阵列几何结构的放大(比例条为500微米)。c)长期实验期间电极阻抗,持续7个月。蓝色三角形标记和红色虚线表示每次会话的平均值,蓝色阴影区域表示标准差。d)在长期实验中每次会话中μECoG信号的信噪比。e)对Y方向所有会话的准确性(相关系数,CC)进行解码。对于每个会话,箱形图表示四分位数范围,标注中位数(蓝线)和均值(方形红色标记),胡须表示最大值和最小值。每个框右侧显示了会话中解码精度的拟合正态分布。f)在体内实验后对植入电极部位和对照位点的组织切片进行了免疫组化染色(与植入电极位置根据矢状面中部镜像对称性),比例条为100微米。g)细胞计数结果(数据归一化至对照位点)和统计分析结果(数据遵循正态分布,采用双侧配对t检验,否则进行Wilcoxon符号秩检验以确定显著性。神经元(NeuN)、小胶质细胞(Iba-1)和星形胶质细胞(GAFP)的NS,p > 0.05,n = 16)。
3.2 电极密度对解码性能的影响
研究发现,随着电极密度增加至64通道/平方厘米,解码精度显著提升,变异性下降。当脑覆盖率缩小至6×6子样本网格时,解码准确率急剧下降。高分辨率μECoG在不覆盖大量皮层的情况下实现最佳性能,支持通过微尺度高密度电极阵列实现开颅手术最小化。

图2、通过提高电极密度提升电机解码性能。a)μECoG信号在电极密度递增子集记录下的HG功率空间分布(即100毫秒时间段内70∼150 Hz频带信号的平均值)。空间分辨率显然得到了提升。b)保持电极密度恒定,同时将子样本网格尺寸逐渐缩小至μECoG电极阵列中心,以模拟脑覆盖率的减少。HG功率的计算方法与(a)相同。c)、d)电极密度(a)增加和子采样网格大小(b)对解码准确性和变异性的影响。蓝色五芒星标记表示解码精度的平均值,阴影区域表示标准差,红色方块标记表示归一化变分系数。e)、f)使用相同通量但密度不同(c)和子样本网格大小(d)的电极子集解码的运动学特征(位置和速度)真实和预测轨迹示例。
3.3 多关节运动解码与精细空间结构
μECoG阵列能够同时解码爪关节、膝关节和大腿关节的运动轨迹。通过随机森林模型评估电极重要性发现,M1内部功能地形在运动编码区域存在空间分离。X和Y方向解码的电极分布比Z方向更广泛,可能与运动幅度差异相关。单个皮层区域编码多方向运动,高空间分辨率μECoG能够解析方向调谐的微架构。
高贡献电极子集在HG波段的信号相关性低于低贡献子集,表明其捕捉了更多运动诱发的神经活动。高贡献子集在三个运动学维度上显著提高了平均解码准确率,表明高分辨率μECoG的解码增强源于小而高度任务相关的大脑区域中精确的空间特异性神经活动。

图3、多关节电机解码与电机编码的精细空间结构。a)坐标轴的定义及关节的实际运动轨迹获取。b)利用3D切片器实现电极通道对大脑MRI重建运动解码的归一化贡献的空间分布。c)多关节电机解码中真实轨迹与预测轨迹的例子。d)电机解码归一化贡献的空间分布,分别在三个方向上。M1中运动编码在毫米级尺度上具有空间特异性,其精细的空间结构可通过μECoG电极阵列进行映射。黄色圆圈代表传统临床电极。e)电极间段内高低贡献电极子组的信号相关性。f)由高贡献子集电极获得的μECoG信号在瞬时位置和速度解码方面表现出显著更高的精度(位置解码,p = 7.17e‐7,n = 39;速度解码,p = 1.37e‐6,****p < 0.0001,n = 39)。
3.4 临床验证与短期体内实验
在术中实验中,患者经过7分钟训练即可通过μECoG信号控制乒乓球游戏(平均准确率0.90)和蛇类游戏(X方向0.73,Y方向0.79)。在为期12天的短期体内实验中,参与者累计进行25,412次试验,总时长19.87小时。从第7天起,参与者能够完全自主控制光标执行中心向外范式,比特率持续增加,最高达1.13比特/秒。对于更复杂的Webgrids范式,经过接口优化后第9天达到最高4.15比特/秒。最终,参与者成功实现了BCI控制的视频游戏、智能轮椅和智能家居系统操作。
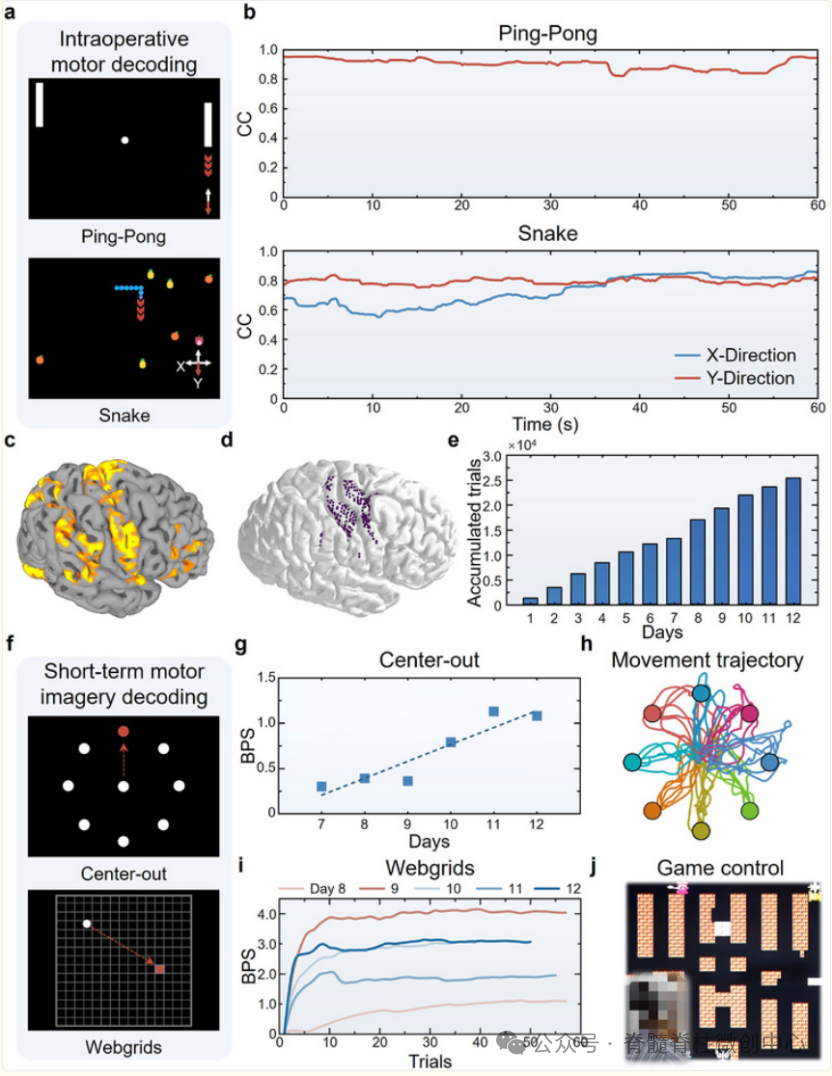
图4、µECoG BCI的临床术中控制和短期稳定控制,用于真实的实时运动和运动想象解码。a)μECoG BCI用于实时运动解码的术中控制范式示意。b)术中实验的实时运动解码性能。c)基于功能性磁共振成像(fMRI)在运动影像范式下重建功能性脑区。d)μECoG电极阵列在参与者右侧皮层表面的大致位置。e)12天体内实验中累计试验次数。f)μECoG BCI用于实时运动成像解码的短期控制范式示意图。g)经过6天适应训练后,参与者展示了对μECoG BCI的完全自主控制,以执行中心向外范式,且比特率在整个实验过程中逐步提升。h)中心向外范式在单一区块内的运动轨迹。i)控制μECoG BCI以执行Webgrids范式的参与者的比特率,跨天计算。j)在完成Center-out和Webgrids范式的适应培训后,参与者使用μECoG BCI进行视频游戏。
04
结论
本研究通过开发了一种长期稳定、高密度柔性μECoG脑机接口系统,实现了高时空分辨率信号的采集。该系统在降低侵入性的同时,达到了与皮层内脑电相当的解码性能,确立了μECoG脑机接口的临床转化可行性。揭示的电极密度与解码性能之间的相关性为μECoG电极阵列设计提供了关键参考。此外,μECoG脑机接口的可扩展密度和通量为精确病灶定位、皮层映射甚至未来家庭使用的神经假肢控制提供了高效的硬件解决方案。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202506663
参考文献:Zhou E, Wang X, Liang J, Liu Y, Yang Q, Ran X, Xia L, Zou X, Liu C, Sun L, Peng L, Chen L, Mao Y, Wu Z, Tao TH, Zhou Z. Chronically Stable, High-Resolution Micro-Electrocorticographic Brain-Computer Interfaces for Real-Time Motor Decoding. Adv Sci (Weinh). 2025 Dec;12(45):e06663. doi: 10.1002/advs.202506663. Epub 2025 Sep 6. PMID: 40913530; PMCID: PMC12677598.
声明:本页面所包含的文章和图片均仅代表作者本人或者该第三方的内容和观点。本页面所载的内容、信息、评论仅为医学专业知识学习和科普宣传,不构成实际治疗建议,也不应用于医疗纠纷判定的依据;本资讯所涉及内容不承担任何依据本资讯制定及履行过程中所产生任何损失的赔偿责任。本文相关信息由网络提供,如有侵权,请联系我们删除。
本文撰写:肖哲浩

审阅:王锐

来源:脊髓脊柱微创中心
仅用于学术分享,若侵权请留言,即时删侵!