点击蓝字 关注我们

英文标题:
Heteroatom modulation of nickel single-atom nanozymes for enhanced interfacial catalytic activity in sensitive electrochemical detection of herbicides

成果简介
除草剂通过根除杂草来提高作物产量,应用广泛,但是其极强毒性和不可生物降解性会导致严重的健康问题和环境污染。阿特拉津(ATZ)是世界上使用最广泛的除草剂之一,是土壤和地下水中较普遍的残留物。因此对痕量ATZ的高灵敏度检测是监测生态污染和减少人类危害的迫切需要。电化学生物传感器因其预处理简便、低成本、高灵敏度和易于小型化备受关注。
开发高效的电极传感界面是电化学检测目标分析物的有效途径。然而,目前的策略往往忽略了催化传感界面的优化。因此,开发有效的催化剂来增强界面氧化还原反应是构建高性能电化学生物传感器的关键。单原子纳米酶(SANs)因其优异的催化活性而备受关注,但其催化性能往往低于天然酶。
在这项研究中,通过杂原子掺杂增强镍基SANs的类酶活性。所制备的Ni-SPNC SANs(SPNC = S、P和N共掺杂的多孔碳纳米结构)表现出优异的类过氧化物酶活性和动力学,超过具有不同原子构型的Ni基SANs,并有效地促进界面氧化还原反应。此外,引入了基于磁性纳米材料的均相靶向识别策略,用于有效的体外靶向识别、DNA分离和富集。适体-DNAzyme马达辅助CRISPR/Cas12a策略通过有效地将靶标转化为扩增的生物信号,进一步提高了灵敏度和特异性。最后结合Ni-SPNC SANs、CRISPR/Cas12a和Apt-DNAzyme马达作为三重信号放大策略,构建了一种新型生物传感器,用于高灵敏度和特异性地检测ATZ。在这种传感策略中,固定在磁性纳米材料上的DNAzyme马达与Apt杂交。在ATZ存在下,Apt优先与ATZ杂交,激活DNAzyme马达的切割活性。激活的DNAzyme马达在Mg2+存在下重复接合并切割发夹(HP)结构以产生触发DNA,其随后通过磁性分离有效富集。一旦触发DNA与CRISPR系统中的crRNA结合,它就会激活CRISPR系统中Cas12a的反式切割活性,其切割聚腺嘌呤(polyA)单链。结果表明,Ni-SPNC SAN不能在电极表面组装,导致检测溶液中3, 3’, 5, 5’-四甲基联苯胺(TMB)的氧化电流很弱。在该信号关闭模式中,信号强度随着ATZ浓度的增加而降低。这项工作开发了一种通过提高界面催化效率来增强电化学生物传感性能的方法,具有高催化活性的杂原子掺杂SANs与Apt-DNAzyme辅助的CRISPR/Cas12a在分析领域应用前景广阔。
研究亮点
催化传感界面优化:
(1)Ni-SPNC SANs表现出优异的类过氧化物酶活性和动力学,能够有效地促进界面氧化还原反应;
(2)通过Ni-SPNC SANs、CRISPR/Cas12a和Apt-DNAzyme马达作为三重信号放大策略实现高灵敏度、特异性检测ATZ。
材料设计创新:
(1)杂原子掺杂:通过P、S共掺杂的长程相互作用的策略,调节与N直接配位的Ni单原子位点的电子结构;
(2)空心碳封装:利用沸石咪唑酯骨架(ZIF-8)包裹含P和S的聚合物,经碳化形成空心碳多面体,有效捕获和封装活化的Ni物种,防止其聚集。
检测性能优异:
(1)宽的检测范围(1×10−5 ~ 10 ng·mL−1)、极低的检测限(2.3 fg·mL−1);
(2)成功用于玉米样品中ATZ的检测,回收率达94.9%~ 98.5%,与HPLC检测结果高度一致。
图文解析
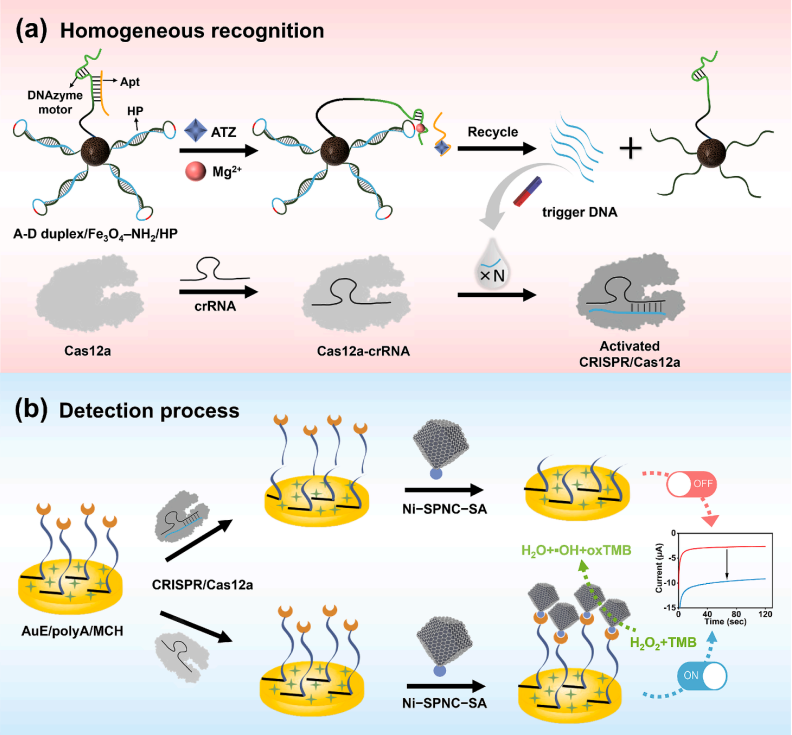
图1. 生物传感器的构建和检测过程的示意图。

图2. a ~ c)Fe3O4-NH2的TEM图像;d)磁性分离之前和之后的Fe3O4-NH2照片;e)XRD图;f)Fe3O4-NH2的FT-IR光谱。

图3. a)Ni-SPNC SANs合成程序的示意图;b)ZIF-8的SEM和TEM(插图)图像;c ~ d)ZIF-8@PZS的TEM和相应的元素映射图;e)Ni-SPNC的SEM和TEM(插图)图像;f)Ni-SPNC的AC HAADF-STEM图像;g)Ni-SPNC的TEM和相应的元素映射图。

图4. a)Ni-NC、Ni-PNC和Ni-SPNC的XRD图;b ~ f)Ni-SPNC的C 1s、N 1s、P 2p、S 2p和Ni 2p的高分辨率XPS光谱;g)Ni箔、NiO和Ni-SPNC的Ni K边XANES光谱;h)Ni箔、NiO和Ni-SPNC的Ni K边k3加权FT-EXAFS光谱。

图5. a)不同样品的紫外-可见吸收光谱:TMB、TMB + H2O2和TMB + H2O2 + SANs(Ni-NC、Ni-PNC和Ni-SPNC);b)不同POD底物(ABTS 和OPD)的紫外-可见吸收光谱;c)以邻苯二甲酸(TA)为捕获探针研究体系的活性氧物种和催化机理;d)所制备的SANs类POD活性的示意图;SANs的稳态动力学测定:(e)400 mM H2O2与不同浓度的TMB,(f)20 mM TMB与不同浓度的H2O2。

图6. 电极每个修饰步骤的a)EIS和b)CV表征:(a) bare AuE, (b) polyA/AuE, (c) MCH/polyA/AuE, (d) activated CRISPR/Cas12a/MCH/ polyA/AuE, (e) Ni–SPNC SANs/activated CRISPR/Cas12a/MCH/ polyA/AuE。

图7. a)三种不同SANs的I-t曲线:(a)Ni-SPNC、(b)Ni-PNC和(c)Ni-NC;b)具有(a)受限DNAzyme马达和(b)自由DNAzyme马达的I-t曲线;c)不含(a)和含(b)Mg2+的I-t曲线;d)不含(a)和含(b)ATZ的I-t曲线。
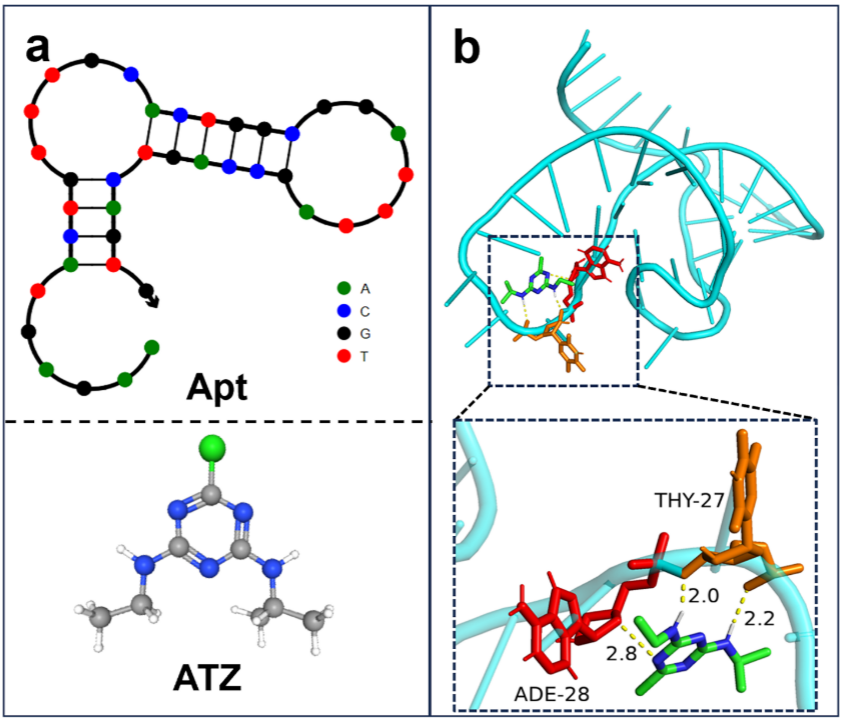
图8. a)Apt和ATZ的二级结构;b)Apt-ATZ相互作用的MD模型(Apt和ATZ之间的对接位点的放大视图)。

图9. a)所开发的生物传感器对不同ATZ含量(1×10−5 - 10 ng·mL−1)的I-t响应;b)电流与ATZ浓度的对数之间的线性相关性,误差棒= SD(n = 3)。

图10. 评价构建的ATZ生物传感器的a)特异性和抗干扰性,b)再现性和c)长期稳定性测试能力。(**:P < 0.01;ns:无显著差异)
研究结论
本研究将Ni-SPNC SANs创新性地与Apt-DNAzyme马达辅助CRISPR/Cas12a整合,构建了用于ATZ的高灵敏度检测的新型生物传感器。杂原子P和S驱动的单原子Ni的配位场变化调节了纳米酶的活性。首次制备的Ni-SPNC表现出优异类POD活性和动力学,高于相应的Ni-PNC和Ni-NC。Ni-SPNC优异的类POD活性显著促进了界面氧化还原反应,从而放大了电流信号。Apt-DNAzyme辅助的CRISPR/Cas12a也被用作生物识别元件以增强单原子生物传感器的性能。因此,所构建的电化学传感平台具有宽的线性响应范围(1×10−5 ~ 10 ng·mL−1)、极低的检测限(2.3 fg·mL−1)、显著的选择性和良好的稳定性。这种典型的基于SAN的电化学传感平台为痕量ATZ的检测开辟了新的途径,显示出创新的除草剂生物传感策略的潜力。
免责声明:原创仅代表原创编译,水平有限,仅供学术交流,如有侵权,请联系删除,文献解读如有疏漏之处,我们深表歉意。


公众号丨智能传感与脑机接口