文献速递


作者:Esmee Dohle, Eleanor Swanson, Luka Jovanovic, Suraya Yusuf, Lucy Thompson, Hugo Layard Horsfall, William Muirhead, Luke Bashford, Jamie Brannigan
摘要
植入式脑机接口(iBCIs)通过解码神经信号控制外部效应器,有望为严重运动障碍(如肢体功能或语言丧失)患者恢复功能。本系统综述分析了iBCI研究的演变及临床转化的关键瓶颈,尤其是缺乏标准化且具有临床意义的结局指标。通过检索MEDLINE、Embase和CINAHL数据库,共纳入112项研究,其中近半数(49.1%)发表于2020年后。全球共确认80例iBCI受试者,为当前最新数据。研究主要集中在美国(83%),欧洲、中国和澳大利亚的贡献逐渐增加。除微电极阵列(MEA)外,基于皮层电图(ECoG)的设备日益普及。iBCI设备现可控制更广泛的效应器,包括机器人假肢和数字技术。尽管69.6%的研究前瞻性报告了结局指标,但主要关注解码性能(69.6%)和任务表现(62.5%),仅17.9%评估了临床结局。临床结局的评估因目标人群差异而高度异质。iBCI有望大规模恢复功能独立性,但仍面临跨受试者泛化、植入可扩展性及结局标准化等挑战。未来需联合工程师、临床医生及运动障碍患者共同开发新型评估指标。
引言
全球数百万人患有神经系统疾病,这些疾病损害了从大脑到肌肉的运动意图传递,使他们无法独立完成日常生活活动(ADL)。中风、肌萎缩侧索硬化症(ALS)和脊髓损伤(SCI)等疾病的负担正在迅速增加,神经系统疾病现已成为全球健康状况不良的主要原因[1]。此外,大多数脊髓损伤患者在50岁之前受伤,导致他们需要数十年依赖他人照顾,生活质量下降[2-4]。
近几十年来,脑机接口(BCIs)已成为一种变革性技术,通过解码保存的神经信号并将这些活动通过计算机传输到效应器设备,从而恢复功能,实现预期动作的执行。这些假肢系统通过记录神经信号、将信号解码为预期输出动作,并通过环境中的效应器执行这些动作来发挥作用。已经研究了各种系统来完成这些步骤中的每一步。传感器可以颅内植入,如微电极阵列(MEAs)、表面ECoG阵列或血管内支架阵列。或者,也可以使用非植入式传感技术,如头皮脑电图(EEG)和功能性近红外光谱(fNIRS)[5]。神经信号的解码可以使用各种神经信号处理技术来完成。输出可以驱动各种效应器,包括机器人假肢[6-8]、虚拟化身[9-11]、消费数字设备[12-15]和解码语音[16-19]。图1展示了一个带有数字设备效应器的典型BCI系统示例。这是一个需要经皮连接的植入式系统示例,近几十年来在研究环境中被普遍使用,取得了重大的工程和科学进展[19,20]。

图 1:植入式脑机接口与数字效应器的实验装置示例。
植入式BCI(iBCI)系统已经取得了重大的临床和工程突破。这包括首次在家中长期独立使用设备(在控制的临床试验环境中)、计算机光标控制、高维假肢控制、通过功能性电刺激或脊髓刺激恢复自身肌肉控制、高速通信输出率,以及提供体感反馈[18,20-22]。虽然使用EEG的非植入式BCI范式已经证明了临床益处[23],并且在实现数字控制方面取得了重要进展[24,25],但颅外电记录受到几个因素的限制。这些因素包括空间辨别能力差、由于信号通过颅骨传输导致的频域低通滤波,以及在常规设置颅外传感器时需要皮肤磨损以获得可用的临床记录。
基于植入式BCI的进展,目前有许多学术和商业努力致力于大规模转化这些系统,作为常规临床实践的一部分,为运动障碍患者恢复功能独立性[15,26]。然而,目前还没有任何iBCI技术获得临床使用的监管批准或被纳入标准临床实践。iBCI设备临床转化的一个主要挑战是在评估临床试验中设备有效性时缺乏对具有临床意义的结局指标的共识[27,28]。在美国,食品药品监督管理局(FDA)强调了缺乏适当结局指标的问题[29],政府资金已被授予用于研究这一问题[30]。
在本综述中,我们提供了全球iBCI临床试验参与者最新且最全面的估计,基于112项研究的数据,并整合了已发表和经过验证的未发表来源。与之前包括癫痫[31]等早期应用背景的综述不同,我们分析的范畴特意限定于涉及运动障碍目标人群的临床试验,包括肢体功能和/或语言丧失。通过聚焦ALS、SCI和中风患者,本综述直接关注那些最有可能从iBCI技术临床转化中受益的人群。我们建立了一个全面的登记系统,不仅作为评估全球iBCI试验现状的新基准,还为利益相关者提供了一个重要资源,以推动这些技术向常规临床应用的进步。
为了给该领域提供背景,我们首先描绘了iBCI研究趋势的演变,记录了随时间的技术进展以及导致当前挑战的各种方法的异质性。我们批判性地考察了限制临床转化的一个关键因素,即当前用于评估iBCI性能的结局指标的异质性。我们提出了关于选择适当和标准化结局指标的展望性解决方案,旨在将讨论扩展到多学科受众,并加速iBCIs融入标准临床实践。
试验方法
本综述根据系统综述和荟萃分析首选报告项目(PRISMA)2020指南进行[32]。完整的检查表见材料SA(补充信息)。本系统综述已在开放科学框架(OSF)上前瞻性注册(https://osf.io/deyri)。
1. 检索策略
在与资深医学图书馆员协商后,制定了一个敏感的检索策略,结合了BCIs、颅内和患者的同义词。该检索应用于MEDLINE、Embase和CINAHL数据库,使用Ovid(Wolters Kluwer, Netherlands),检索时间从建库至2024年12月24日。检索策略见材料SB(补充信息)。通过检索纳入记录的参考文献列表和该领域主要研究者的Google Scholar个人资料,确定了更多研究。
2. 研究选择
由两名独立评审员(ED, ES)筛选纳入记录。首先对50条记录进行初步筛选以确保一致性,之后评审员使用Rayyan(Rayyan Systems Inc, Cambridge, MA, USA)互盲对方的决定。分歧通过共识或与第三位评审员(JB)讨论解决。由相同评审员(ED, ES)进行全文筛选。
3. 纳入和排除标准
如果研究展示了使用具有颅内传感组件和效应器的植入式BCI设备,则予以考虑。就本综述而言,植入式BCI被定义为一种颅内设备,记录代表自主运动意图(如预期的肢体运动或语言)的神经活动,并将其解码为输出信号以控制外部效应器[25]。非植入式BCI先前已被详细讨论,其在提供具有临床意义的运动功能恢复方面潜力有限[5,33-35]。
表 1.排除标准
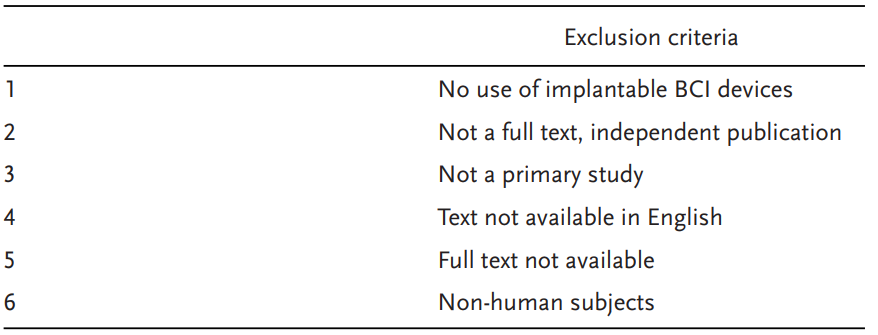
人工耳蜗是感觉假体,既不记录神经活动也不控制外部设备,因此未纳入本研究[36,37]。主要目的是辅助围手术期计划(如癫痫灶定位)的短暂设备植入研究被认为超出了本综述的范围。所有英文全文原始研究论文均被考虑。专门报道非人类受试者的研究被排除。向评审员提供的排除标准概述见表1。
4. 数据管理、提取和评价
使用Rayyan对记录进行去重[38]。随后,由两名独立评审员通过标题和摘要对记录进行盲法筛选。使用MS Excel中经过试验的数据提取表格进行全文筛选和数据提取。由两名评审员使用混合方法评价工具检查表评估偏倚风险。使用Zotero进行参考文献管理。
5. 数据合成
使用Tidyverse包在R(R Core Team, 2019)中进行分析。由于许多参与者在多项研究中被报告,因此对纳入研究进行交叉引用以匹配相同参与者,避免人口统计学细节重复[39]。使用ggplot2包在R中生成图表[40]。改编先前发表的开源R代码创建图2所示地图[41]。使用Inkscape(Inkscape Project, 2020)制作图形。
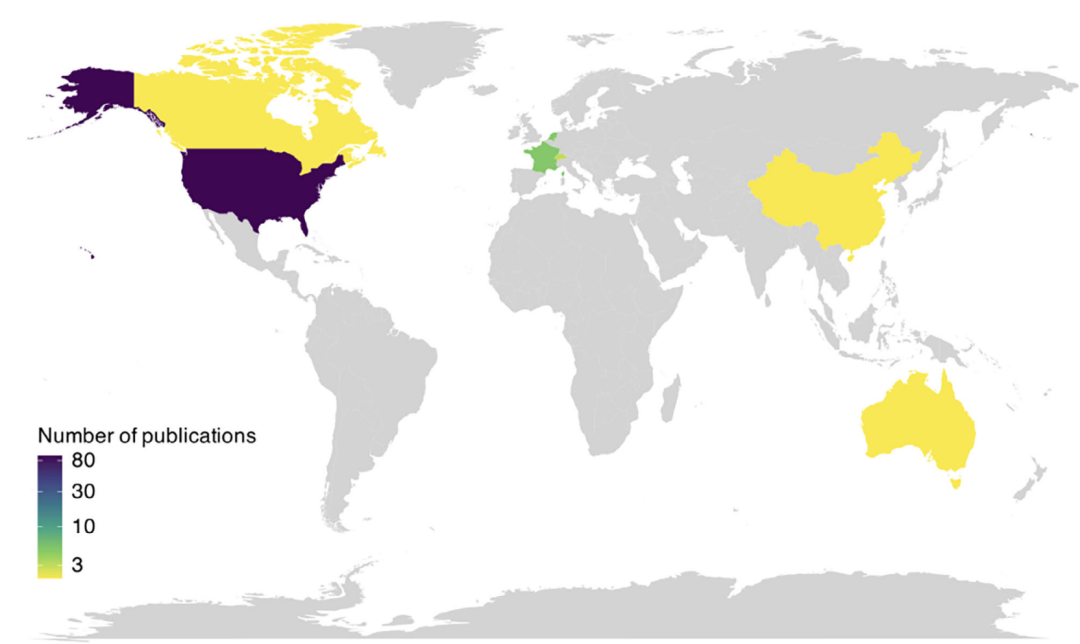
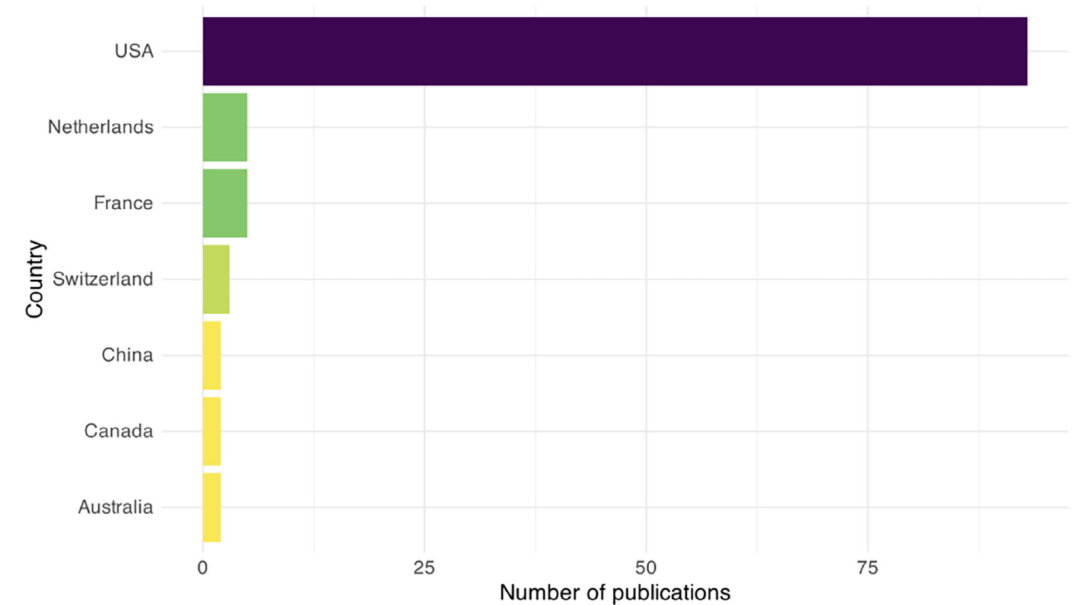
图 2:研究团队所在地的发表数量分布。
美国占比最高(83%),其次为荷兰、法国等。
将出版物按5年间隔分组。图3、4和7显示了不同类别随时间变化的比例,排除了发表研究≤3篇的时间间隔。
对报告使用iBCI进行交流的研究进行了亚组分析,包括通过光标控制打字或语音音素解码范式。为了比较不同研究随时间实现的交流速度,使用常用转换因子WPM = CPM/5将正确字符每分钟(CCPM)估计值转换为单词每分钟(WPM)。当速度以字符每分钟报告时,将其与报告的错误率结合计算正确字符每分钟的估计值。对于每位参与者,使用达到的最高平均速度,即使借助了额外技术(如预测打字或改变键盘布局)。准确率在所有参与者中取平均值。如果报告了错误率,则通过计算100 - 错误率转换为准确率。实现交流的方法(即光标控制打字或语音音素解码)在附图(图5)中直观标示。
在数据提取过程中,结局指标分为三类:
1)解码器性能评估(如分类准确率),
2)任务性能评估(如成功获取目标),或
3)定义的临床结局评估(如分级重新定义的强度、感觉和握力评估,GRASSP量表)。对每个目标人群报告的结局指标进行了亚组分析,排除了不良事件报告,因为这与任何目标人群无关。该分析结果如图6所示。
结果

图 3:
A) ECoG、MEA和血管内设备示意图;
B) 不同传感器类型随时间占比变化。
1. 检索结果
我们的检索在三个数据库(MEDLINE: 1787; Embase: 2416; CINAHL: 436)中共识别出4639条记录。去重后剩余2966条记录,其中382条被选为全文筛选。此外,通过Google Scholar检索确定了714条记录。最终分析共纳入112项研究。完整的PRISMA流程图见材料SC(补充信息)。
2. 研究特征和参与者人口统计学
本综述纳入2000-2024年间发表的112项研究。研究特征概述见表2。对iBCIs的研究兴趣随时间显著增加,近半数出版物(49.1%, n = 55)自2020年以来发表。大多数纳入研究(69.6%, n = 78)前瞻性报告了结局指标。所有纳入研究的详细信息见材料SD(补充信息)。
表 2. 纳入研究的特征

由于一些研究参与者在多篇出版物中被纳入,我们交叉引用了所有112项研究,确定已发表文献中共有57例独特的iBCI参与者。通过未发表文献(包括会议报告、新闻稿、与正在进行的临床试验主要研究者的电子邮件通信,以及测试iBCIs的公司的博客文章)进一步确认了23例参与者,使全球iBCI使用者总数达到80例(截至本文发表时)。未发表文献中报告的参与者数据未纳入进一步分析。各研究组植入参与者数量的概述见材料SE(补充信息)。
大多数(78.9%, n = 45)参与者为男性,平均年龄45.4岁。导致这些参与者运动障碍的主要疾病为脊髓损伤(SCI, 40.4%, 23例患者)、肌萎缩侧索硬化症(ALS, 31.6%, 18例患者)和中风(14%, 8例患者)。为清晰起见归类为"其他"的更罕见疾病包括脊髓小脑变性、线粒体肌病、臂丛神经损伤、特发性震颤和慢性疼痛。参与者人口统计学概述见表3。
表 3. 已发表文献中研究参与者的人口统计学数据
3. 研究地点
大多数出版物(83%, n = 93)来自美国的研究团队,其中BrainGate联盟是最大的贡献者。美国以外,法国、荷兰、瑞士、加拿大、澳大利亚和中国也做出了贡献(图2)。我们注意到2010年前发表的所有出版物均来自美国,而2020年后76.4%的出版物来自美国,表明虽然美国仍占主导地位,但有轻微的去中心化和地域多样化趋势。
4. 传感器趋势:MEA与ECoG
大多数iBCI研究(69.9%, n = 78)使用微电极阵列(MEA)记录神经信号,通常是96电极、基于硅的Neuroport电极(通常称为"Utah阵列",Blackrock Neurotech)。MEAs可以检测代表单个神经元去极化事件的高频尖峰,以及其接触点周围细胞外空间较慢频率的局部场电位(LFP)。ECoG电极通常放置在硬膜下或硬膜外,无法捕捉单个神经元去极化事件的信号,但记录振荡LFP活动。历史上,ECoG阵列在癫痫灶定位和肿瘤边界划分中发挥了关键作用,这一实践由Wilder Penfield开创,促进了今天各种商业可用系统的发展。最近,记录ECoG活动的血管内支架阵列已成功应用于人类研究[15,42]。自2020年以来发表的研究中,55%的出版物报告使用MEA(n = 22),40%使用ECoG(n = 16),5%使用血管内设备(n = 2)。不同植入类型随时间的使用比例见图3。
5. 效应器趋势
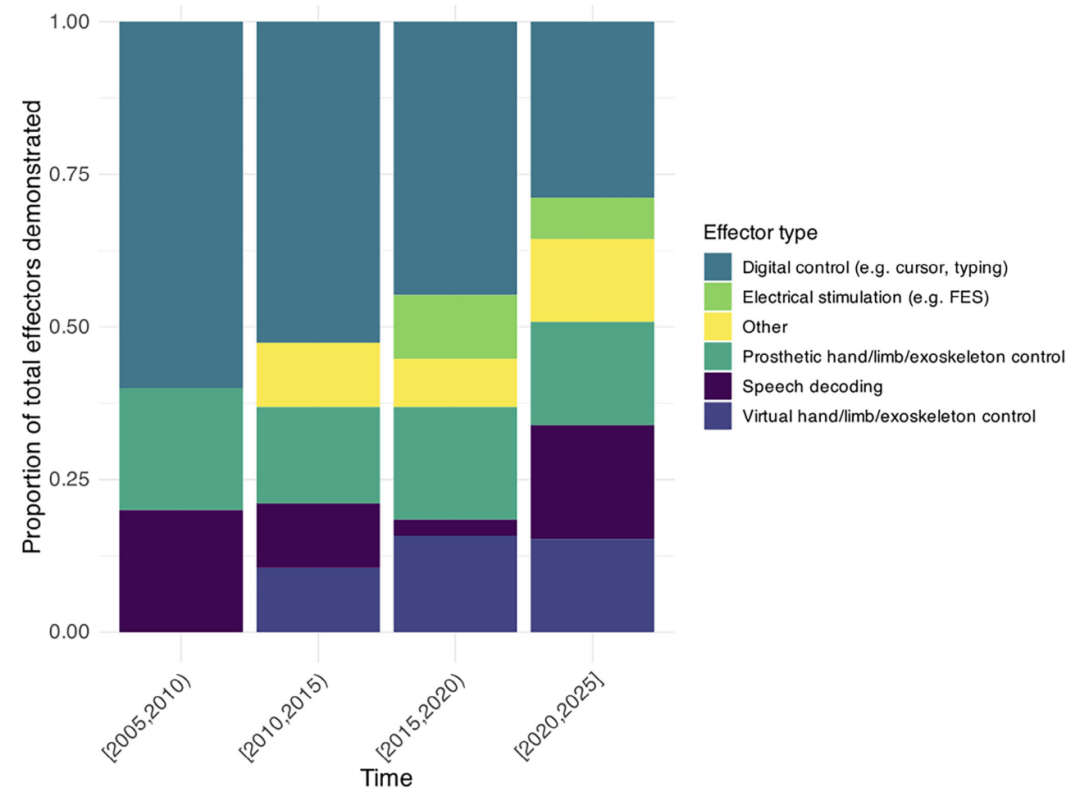
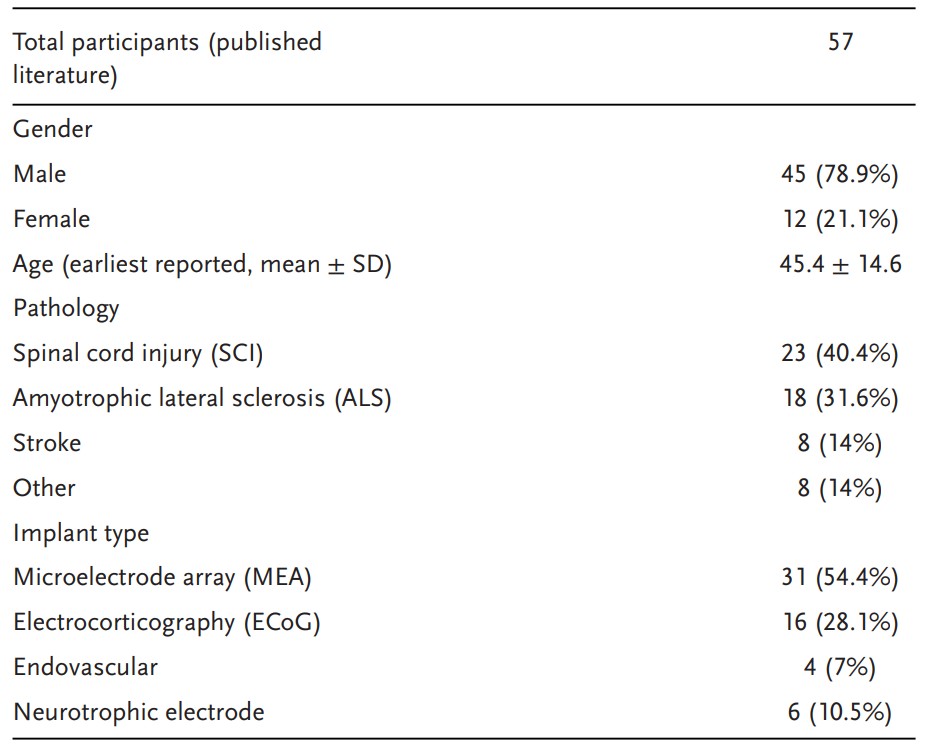
图 4:不同效应器类型随时间占比变化。早期以数字控制为主,近年语音解码和假肢控制增加。
BCIs已尝试使用各种效应器,最终目的都是恢复功能独立性。这些效应器可以是消费数字设备(如控制计算机、平板电脑或手机屏幕上的光标)、机器人假肢手或肢体的运动、电刺激(如功能性电刺激,FES)、解码语音或虚拟肢体或化身的运动。最早的出版物主要使用数字设备效应器,通常是计算机屏幕上的光标控制或中心-外围目标任务。然而,随着神经解码和机器人技术的进步,已经测试了机器人假肢和外骨骼。此外,虚拟效应器(如虚拟化身的运动)已在最近的出版物中得到展示。2020年后出版物中,28.8%的iBCI出版物涉及数字控制,18.6%为语音解码,16.9%为假肢/外骨骼控制,15.3%为虚拟肢体/化身控制,6.8%为电刺激(如FES),13.6%为其他效应器。出版物中效应器类型随时间的变化见图4。
6. 交流速度
图 5:
A) iBCI通讯速度(WPM)随时间进展,虚线标注智能手机打字速度(36 WPM);
B) 两种通讯方式示意图:光标打字与语音解码。
一些出版物报告了使用iBCI恢复交流能力的尝试。2020年前,这是通过控制光标或基于点击的拼写器在视觉显示的键盘上进行选择来实现的。过去4年中,一些研究转而采用基于语音解码的方法,使用对应于口面部肌肉的运动皮层区域记录,并从预定义词汇中解码。虽然这些是概念上非常不同的方法,但我们能够使用等效单位进行比较。本亚组分析中纳入的研究,包括报告和转换的语音,列在补充信息中。
使用语音解码,一项研究使用1024词词汇表达到了78 WPM的创纪录交流速度[18],超过了人类智能手机打字速度(36 WPM)[43],并开始接近自然对话速度(160 WPM)[45]。另一项发表在Nature同一期上的研究实现了略低的62 WPM交流速度,但使用了更大的125,000词词汇表,展示了成功的大词汇量解码[44]。
实现的交流速度见材料SF(补充信息)。
7. 报告的结局指标类型
在不同类别的结局指标中,解码相关结局(如解码准确率)是最常报告的,占出版物的69.6%(78篇出版物)。任务相关结局,如成功完成任务或目标准确率,也在大多数出版物中报告(62.5%, n = 70)。临床结局使用较少,只有17.9%(20篇出版物)报告了临床结局。
8. 临床结局指标
使用的临床结局指标差异很大,20篇出版物共报告了20种不同的临床结局。报告临床结局的研究中恰好一半(n = 10)发表于2020年后。
在调查SCI患者群体中iBCIs的出版物中,临床结局指标最常关注上肢功能,经常使用动作研究手臂测试(ARAT)等指标。相比之下,在涉及ALS患者群体的出版物中,没有单一特定类别的结局指标占主导地位,这可能是因为ALS的损伤范围超出了运动功能。在这些研究中,使用了更一般的结局指标,包括ADL评估、辅助设备功能和生活质量评估。这如图6所示。

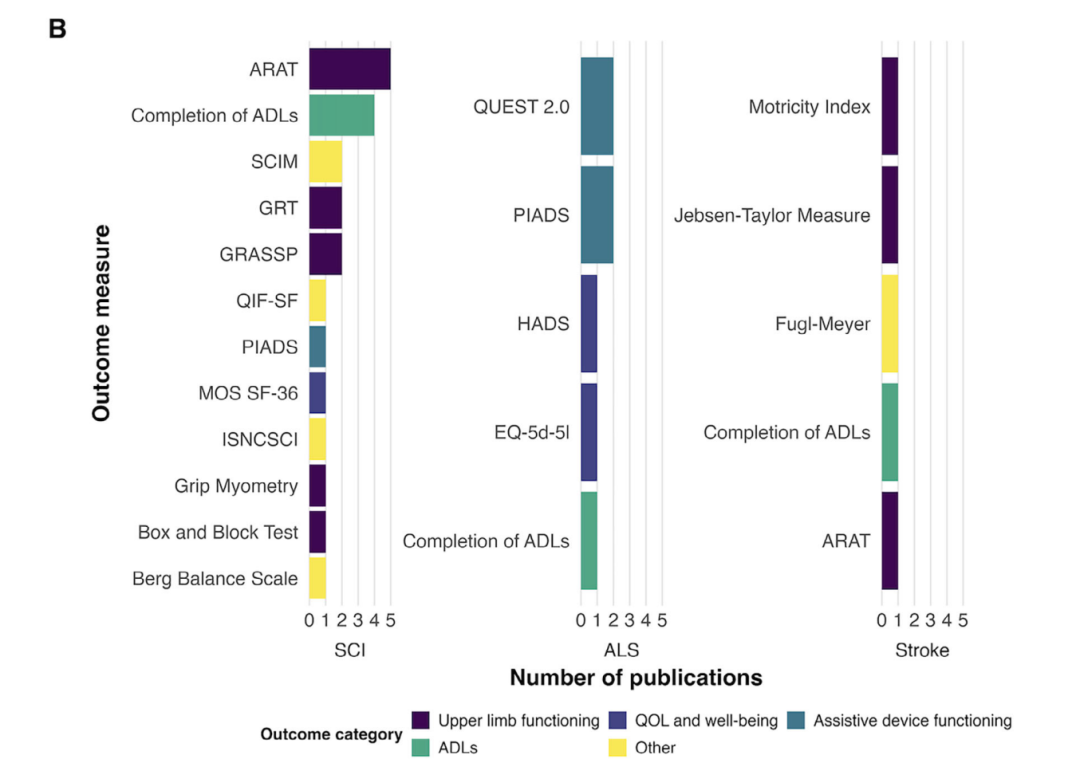
图 6:
A)按类别分组的每个目标人群报告临床结局指标的出版物百分比。
B)按目标人群报告个体临床结局指标的出版物数量。ARAT = 行动研究臂测试;BBS = 伯格平衡量表;BBT = 箱块测试;EQ-5d-5l = 欧洲生活质量 - 5d-5l;FMMIS=Fugl-Meyer 运动障碍评分;GRASSP = 强度、敏感性和抓握能力的分级重新定义评估;GRT = 抓握释放测试;HADS = 医院焦虑和抑郁量表;ISNCSCI = 脊髓损伤神经学分类国际标准;MOS SF-36 = 医疗结局研究简表 - 36;PIADS = 辅助设备的社会心理影响量表;QIF-SF = 四肢瘫痪功能指数 - 简表;QUEST 2.0 = 魁北克辅助技术用户满意度评估 2.0 版;SCIM = 脊髓独立性测量。
9. 解码和任务相关结局指标
最常报告的工程结局指标是准确率,74.1%的纳入研究(83篇出版物)报告了这一指标。最常报告的是模型准确率,例如解码或分类准确率(45.5%, n = 51),其次是任务准确率,例如任务成功率或准确率(42.9%, n = 48)。
几项研究涉及为辅助交流目的开发的iBCIs,例如通过光标控制打字或语音/音素解码。在112项总研究中,18项研究报告了交流速度结局指标,如正确字符每分钟(CCPM)或单词每分钟(WPM)。这些研究中,大多数(11篇出版物)使用基于字符的指标如CCPM或CPM,但最近的研究(7篇出版物)倾向于使用基于单词的指标如WPM。另一个速度指标,信息传输率(ITR)及其衍生指标,在9项研究(占所有出版物的8%)中报告。
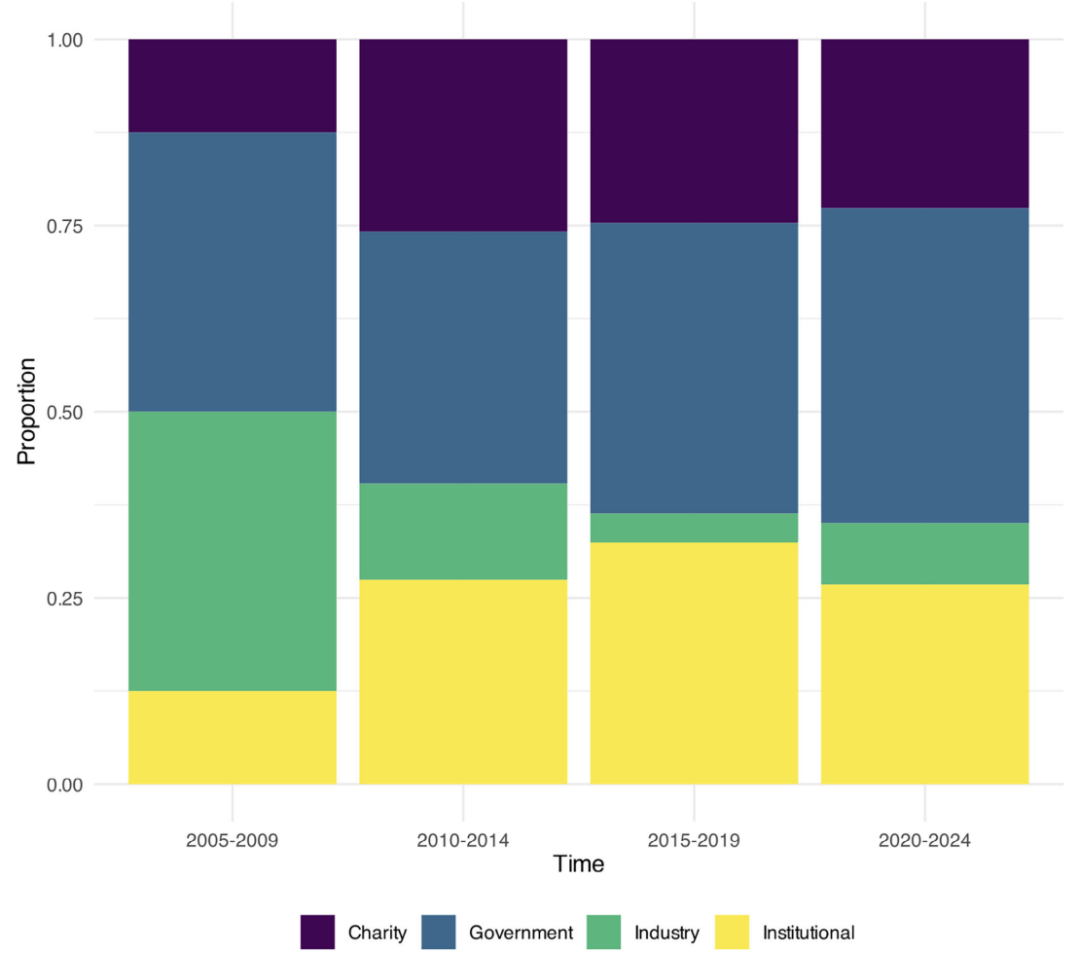
图 7:资金来源比例变化。政府资助稳定,产业资助近年下降。
10. 资金来源
资金来源大致分为政府、产业、地方机构(如大学)和慈善机构。没有记录资金数量。如图7所示,政府资助的研究比例随时间保持相对稳定。在所有资金来源中,产业资助的研究比例近年呈相对下降趋势,从2005-2009年出版物的37.5%降至2020-2024年的8.2%。
讨论
本系统综述描述了运动iBCI研究的演变,并评估了用于评估设备性能的结局指标。我们提供了植入BCI的最新估计,基于112项研究数据确定了80例全球参与者。我们发现对iBCIs的研究兴趣迅速增加,伴随着地理、临床和工程重点的演变。然而,很少有研究使用经过验证的临床结局指标,即使使用,这些指标也各不相同,且通常特定于正在执行的任务类型。
1. 地理趋势
我们的综述表明,绝大多数iBCI研究由美国团队进行。这与最近一项主要针对非植入式BCI研究的分析形成对比,后者表明中国在非植入式BCI研究中的比例显著且不断增长[46]。这反映了美国数十年来培育的先进iBCI生态系统,受益于早期政府资助[47]和FDA研究性器械豁免框架[48],涉及临床医生、工程师、科学家和多个政府机构之间的长期合作[49]。
我们的分析还揭示了一些由欧洲和澳大利亚高度本地化集群驱动的高影响力成果,包括荷兰乌得勒支、法国格勒诺布尔和澳大利亚墨尔本的团队。鉴于iBCI研究的高度多学科性质,这种集群可能得益于工程、神经科学和临床专业知识的集中。
2. 演变的临床重点
我们的综述显示,iBCI设备主要在ALS、脊髓损伤和中风导致的运动障碍个体中进行研究。近年来,我们观察到涉及临床损伤更严重的患者(同时影响肢体运动和语言能力)的研究比例增加(完整出版物列表见材料SD,补充信息)。值得注意的是,2016年,Vansteensel及其同事发表了首项在晚期ALS患者中使用完全植入式BCI系统的研究,通过简单可靠的数字运动输出展示了有意义的恢复功能[12]。这项工作突出了BCI设备在家庭独立使用的潜力,特别是在运动障碍更严重的个体中,对iBCI技术的需求最为明确。后续出版物继续基于这些发现,并涉及疾病更晚期的个体[16,15,50,51]。招募更严重损伤的个体也受到语音iBCIs发展的影响,这些研究已涉及完全构音障碍的个体[18,19]。相比之下,早期iBCI研究主要涉及保留语言能力的SCI个体,代表四肢瘫痪肢体损伤的最大人群[52]。
随着数字生态系统的发展,人们越来越依赖数字界面进行ADL,包括交流、财务管理、购物、休闲和与医疗保健提供者互动。这使得数字访问比以往任何时候都更加关键。虽然早期研究主要关注恢复SCI患者的身体功能,通常得到美国退伍军人事务部的重大资助,但最近强调完成可以通过数字方式进行的ADL[12,15,50,51,53]。
语音iBCIs通过检测和分类尝试或想象语音时的音素及随后的单词,使用语言模型,在交流速度方面取得了重大进展。这反映了音素分类模型的新发展,以及计算机处理速度的显著提高和自然语言处理在语音解码器设计中的结合。在这些出版物中,解码器都是使用英语词汇和音素集进行训练和测试的。目前尚不确定解码性能是否会转化为如普通话这样的声调语言,这些语言依赖音高和声调传达意义,给分类带来挑战[54]。如科萨语和祖鲁语这样的点击丰富的语言可能给当前解码器带来进一步挑战。鉴于全球很大比例人口使用声调语言,未来研究必须解决这一问题。为此,最近一篇预印本已证明从皮层内记录中成功解码副语言特征,表明可以从现有记录位置解码语言的必要组成部分[55]。
我们发现在BCI参与者人群中存在显著的性别不平衡,超过四分之三的参与者为男性。根据最近的分析,这超过了高影响力临床研究中的平均偏倚[56]。一个可能的解释是男性SCI发病率更高,几乎是女性的两倍[57]。ALS中也观察到类似的性别不平衡,男性发病率高出20%[58],而中风发病率在两性间大致相等[59]。然而,女性入组对于识别或排除iBCI植入和功能方面任何与性别相关的差异至关重要。
3. 工程趋势和未来潜力
本综述强调的一个趋势是ECoG基系统使用和性能的增加。尽管ECoG信号分辨率限于局部神经元群体而非单个尖峰,但这些iBCI系统近年来与MEA方法一起日益突出。虽然MEA系统可以直接记录来自单个神经元的尖峰活动,但它们需要皮层穿透,通常从较小的皮层区域采样,且尚无已发表研究展示完全植入的MEA iBCI的使用。历史上,尽管临床侵入性更大,但MEA系统优越的空间分辨率使其使用受到青睐。然而,微加工技术的进步允许更高的通道数和改进的信号传导[60-62],使得记录质量和随后的iBCI性能显著提高。2023年,基于ECoG的iBCIs首次在通讯输出速度上超过基于MEA的iBCIs,尽管值得注意的是基于MEA的BCI研究展示了从显著更大的词汇表中解码,使直接比较复杂化[18,44]。这些使用ECoG设备的研究的出现伴随着神经解码中对频谱特征的日益依赖。此外,还开发了新的记录方法,包括支架嵌入式电极的血管内记录,这些方法不需要神经外科输送,可能允许访问深部脑区的目标[15,50]。
iBCI通讯输出速度通常作为工程性能的基准,在多年显著较低的基线性能后,2023年超过了正常打字速度。通讯解码性能的快速提高受到新解码范式和理解语言与语音皮层表征突破的催化[19,63,64]。2021年前,BCI通讯输出的基准研究依赖于键盘界面的点按控制来恢复打字能力[65]。随着范式转变为解码尝试的手写,首次报告了输出速度的三倍提升,将方法从计算机光标的回归控制转变为31类分类问题[64]。这一进展随后被解码尝试语音远远超越,聚焦于从对应于声道运动皮层区域解码音素[18,19,44]。这项工作之前有十多年的开创性研究来描述语音的神经基础[66,67]。我们预计使用这种方法通讯速度的增加将在自然对话速度(160单词每分钟)达到平台期[68]。任何超过这一水平的未来进展可能需要新的范式,如在联合皮层解码语义信息[69]。然而,有人提出人类认知的信息吞吐量近似于语音输出的上限,表明语音的平台期可能会长期持续[70]。即使通讯速度受到这一自然阈值的限制,在更准确地捕捉人类语音复杂性(包括音高、节奏和音量等副语言特征)的其他领域仍有有意义的进展空间[55]。实际上,iBCI系统必须代表自然人类语音的所有特征,才能完全恢复口头表达自我的能力。
除了这些通讯速度的突破外,在开发植入式BCIs恢复 locomotion 方面也取得了重大进展。在一项开创性研究中,Lorach等人展示了从感觉运动皮层上的ECoG阵列可靠记录与运动相关的神经信号[71]。这些信号被解码并用于触发不完全颈髓损伤患者脊髓的硬膜外电刺激。这种"脑-脊接口"实现了站立和行走的自主控制,并有助于神经康复,即使在无刺激情况下功能改善也持续存在[71]。
未来十年,iBCI系统预计将进一步发展,设备将完全植入并具有无线神经遥测功能,同时先进的解码范式可能既增加能力又减少重新校准需求。解码器设计不断改进,能够在更大数据集上实现更好的性能,Lim等人最近的一篇综述对不同解码器进行了出色概述[31]。行业实验室正在开发新设备,并获得大量资金支持,包括Neuralink Corp.、Synchron Inc.、Paradromics Inc.、Precision Neuroscience、Echo Neurotechnologies和Science Corporation。Neuralink和Paradromics都采用使用完全植入皮层内微电极的方法。在最近的一篇博客中,Neuralink报告在2例个体中实现了首个允许家庭独立使用的完全植入iMEA基系统[53]。Precision Neuroscience目前正在两项临床试验中研究其侵入性较小的薄膜MEA基iBCI,称为第7层皮层接口,并最近成功完成了1.02亿美元的C轮融资[72,73]。Synchron采用了另一种硬件方法,使用通过微创神经介入手术放置在矢状窦中的支架电极设备。2021年获得FDA首个研究性器械豁免(IDE)后,Synchron迄今已在其设备中植入了10例患者,包括美国COMMAND研究(NCT05035823)中的6例。
尽管有这些进步,值得注意的是,采用先进的机器学习方法来改进解码落后于其他领域[74,75]。一个关键限制是由于人类植入和记录会话数量有限导致可用数据集相对较小。因此,iBCI系统倾向于在逐个受试者的基础上开发和校准,而不是尝试训练利用高级神经网络架构的通用跨受试者模型。然而,非侵入性数据收集方法如EEG或MEG促进了在健康志愿者中收集大型数据集。最近一项MEG数据研究将先进的自我监督计算机视觉方法应用于MEG数据,以解码跨个体的视觉感知,表明从iBCI设备记录的大型数据集中跨受试者模型的可行性[76]。作为进一步的挑战,iBCIs需要实时解码以实现最佳功能,这意味着模型必须快速,如果在植入硬件上运行,还必须节能。这为实施计算更密集的算法提供了进一步的挑战。最后,人们对神经网络输出的可解释性存在担忧,当技术临床部署时这种担忧会加剧。
4. 行业资助的研究产出
对所有iBCI出版物资助者的分析显示,多年来行业资助者的比例相对下降。这与近年来商业iBCI努力获得的私人资金空前水平形成对比[77-79],相对于政府资金[80,81]。行业产出相对下降的可能解释包括对可扩展转化的有限数量iBCI应用的核心关注、作为单一可行性研究一部分招募更大队列,以及相关的监管负担增加(NCT05035823)。几家公司选择通过大众媒体传播结果,如Neuralink最近在社交媒体平台X上直播展示其研究参与者中的iBCI功能,偏离了传统的科学出版模式[82]。
相比之下,政府资金随时间保持相对稳定,报告政府资助的出版物比例一致。这些资金最常由美国政府提供,BRAIN计划[83]、退伍军人事务部和国防高级研究计划局(DARPA)做出重大贡献[47]。随着BRAIN计划资金的大幅减少,美国政府资金可能在今后几年减少;然而,新的政府资金来源也可能出现,如英国高级研究与发明署(ARIA)和美国健康高级研究计划署(ARPA-H)[84,85]。
虽然过去二十年来iBCI研究的总体资金稳步上升,但由此产生的科学进步因资金投向而异。DARPA计划(如人类辅助神经设备和革命性假肢)催化了通过iBCIs控制机器人肢体的基础性突破。随后的BRAIN计划支持不仅推动了机器人控制的进一步创新,还支持了直接促成今天语音神经假体的语音产生基础研究。最近,行业研发聚焦于将已建立的解码能力与消费者平台整合,将学术概念验证转化为旨在最大化规模临床效用的设备。尽管如此,尽管iBCI公司获得了前所未有的资金水平,学术资助对于降低新设备概念和实验范式的风险仍然不可或缺,这些无法吸引私人资金。
5. 工程相关结局指标被一致选择
解码器和任务性能的工程测量在纳入研究中最常且一致地使用。83项研究(74.1%)测量了准确率。与速度相关的性能测量,如每分钟字符数或比特率,仅用于18项研究(16.1%)。将设备准确率作为工程指标的偏好与患者偏好文献一致,表明患者优先考虑高准确率而非iBCI性能的其他方面,如速度[86]。虽然常用且作为性能特征受患者青睐,但准确率是一维测量,不提供任务难度或复杂性的信息,例如自由度、使用的认知负荷或训练负担。此外,准确率的孤立测量不考虑任务执行的环境背景。因此,此类工程测量不考虑个体在日常生活中的感受和功能[87],美国食品药品监督管理局将这些评估称为"实验室测试",而非现实世界功能的评估[28]。包含准确率等工程指标可能仍有助于评估BCI设备性能;然而,需要额外的现实世界功能评估来确定临床益处。
准确率通常在任务层面定义,即成功试验数/总试验数,70项研究(62.5%)采用此评估。在任务层面的定义最适合跨不同iBCI研究的应用,因为它是离散、连续和混合离散/连续iBCI应用的标准化准确率测量。其他定义,如分类准确率,特定于解码运动意图时采用的范式性质。
虽然信息传输率或语言输出的每分钟字符数也被引用为BCI功能的测量[28],但这些评估在iBCI性能的基准研究中过度代表,在整个文献中较少使用。然而,可能只有当成功展示新突破时才报告这些测量,因为学术文献中对低或失败结局指标的报道较少。
6. 临床iBCI结局指标使用增加,但高度异质
临床结局指标选择较少,只有20项研究(17.9%)报告了临床结局指标。这20项研究中,一半(50%, n = 10)自2020年后发表。尽管评估iBCI设备临床益处的兴趣日益增加,但目前使用的评估存在显著变异性。这种异质性部分反映了目标患者人群的差异和每项研究中解决的具体功能领域。值得注意的是,这主要由不同患者群体中使用的外部效应器驱动,而非患者群体内在差异。
例如,涉及脊髓损伤(SCI)参与者的研究通常聚焦于尝试控制上肢,因此采用现有的、经过充分验证的上肢功能测试,如ARAT、分级重新定义的强度、感觉和握力评估(GRASSP)和抓握释放测试(GRT)。这与患者优先研究一致,表明恢复手臂和手功能是四肢瘫痪患者的具体优先事项[88]。对这些结局指标的更仔细评估揭示了相似性和关键差异。所有三个都是客观性能指标,量化手和手臂功能的各个方面,并已广泛应用于运动障碍研究人群,如中风或脊髓损伤导致的运动障碍,类似于iBCI研究中的目标队列。这些测量中,ARAT通过评估精细运动技能(包括抓握、握力和捏力)和功能任务所需的大运动动作提供最全面的评估。相比之下,GRASSP超越运动表现,还评估触觉和本体感觉反馈。这种感觉成分可能使GRASSP高度适合旨在整合运动输出和感觉反馈的iBCI试验。然而,在干预主要针对增强运动输出的试验中,感觉成分可能增加复杂性而不改善反应性。最后,GRT因其简单性和对重复抓握释放任务期间速度和灵活性变化的敏感性而有价值。然而,它不捕捉更广泛的功能领域,如大运动力量或(大运动动作,总体力量),因此不适合作为旨在恢复运动的iBCI试验的唯一结局指标。最后,值得注意的是,Fugl-Meyer评估常用于临床实践,并已用于中风患者的iBCI试验[89],提供了对偏瘫中风后跨感觉和运动领域的运动恢复的稳健评估。这些现有结局指标可能作为多组分结局指标框架"功能"域的一部分有用(见第4.7节)。
相反,聚焦肌萎缩侧索硬化症(ALS)参与者的研究倾向于使用更一般的评估,包括ADL测量、辅助设备性能和满意度,以及生活质量。这可能是由于在ALS iBCI研究中较少努力使用假肢,导致功能评估围绕恢复数字设备控制的ADL。值得注意的是,当评估ADL时,通常按活动逐一评估,而非使用标准化工具。目前不存在捕捉恢复数字功能独立性的ADL测量,尽管Fry等人和美国食品药品监督管理局提出了"数字ADL"工具(28,29)。我们的综述中确定了几种QoL测量,如EuroQol-5D-5L。它们的好处是与设备类型和恢复的功能无关。然而,QoL评估通常仅作为评估治疗干预时的补充测量。它们常受社会经济因素、心理健康和合并症的影响,并可能因患者对缺陷的心理适应而保持升高[90]。虽然在干预随机研究中捕捉患者报告结局是必要的[91],QoL测量可能是最合适的评估,但这些挑战可能限制QoL评估作为iBCI设备临床益处主要测量的潜力。
7. 迈向标准化和具有临床意义的iBCI结局指标
鉴于设备类型、患者选择和iBCI应用固有的异质性,不太可能开发出一个单一的全面测量来评估总体iBCI临床益处。根据FDA指南和Fry等人(2022),BCI临床结局指标可能围绕三个维度构建:患者"感受"(如生活质量评分)、患者"功能"(如ADL量表)和患者"生存"(如健康相关结局,包括设备安全性)[27]。
在某些iBCI应用中,可以在此框架内使用现有结局指标。例如,在旨在通过脊髓损伤恢复 locomotion 提供功能益处的iBCI试验中,10米步行测试或计时起走测试可以量化"功能"域的移动性。类似地,聚焦SCI中上肢运动功能恢复的iBCI研究可以使用现有评估如ARAT评估患者"功能"的改善。其他结局指标如PIADS或SF-36可用于评估"感受"域。患者"生存"可通过系统监测不良事件评估,最终在更大队列或荟萃分析中,可能测量代表患者生存方面积极、临床意义效应的结局(如心血管益处)。包含评估照顾者负担的结局指标,如Zarit负担访谈[92]或照顾者反应量表[93],可能对捕捉iBCIs的更全面影响很重要,也可为报销决策提供有价值的见解。
然而,在近期内,对于所有目标人群,第一波临床转化的iBCI设备可能主要旨在恢复数字设备和/或通讯控制(如BrainGate2 (NCT00912041)、Neuralink PRIME (NCT06429735)、Synchron COMMAND (NCT05035823)和BRAVO (NCT03698149))。这表明迫切需要能够捕捉数字功能独立性改善的结局指标。除了新型数字ADL工具外,另一个有前景的发展是Sawyer等人提出的数字运动输出概念。测量数字运动输出,即iBCI将运动意图可靠转化为数字输出的能力,确保任何性能测量与特定研究中使用的外部效应器设备无关,并可能允许不同iBCI系统之间的有意义比较[94]。然而,这可能不是评估语音神经假体性能的适当框架,其中自然语音现在可以直接从解码神经信号合成,无需解码运动学的中间步骤。
选择和开发适当的临床结局评估必须涉及多利益相关方共识[28],包括具有严重运动障碍生活经验的个体意见。这对于确保未来设备结局匹配用户的优先事项和期望至关重要。此外,鉴于多家公司努力大规模转化iBCI设备,这项工作还应确保不同商业参与者之间的合作。在美国,创建iBCI协作社区(iBCI-CC)是推动这项工作的重要一步(ibci-cc.org),同时监管机构组织多个研讨会讨论iBCI临床结局评估[28,29]。
8. iBCI注册表:iBCI临床试验参与者的国际注册表
为了鼓励研究团队之间的合作并促进数据共享,最终推动iBCI技术的临床转化,我们建立了iBCI临床试验参与者的国际在线注册表。该注册表包含来自同行评审出版物和与研究团队直接沟通的参与者水平数据,包括人口统计信息、设备细节和出版物链接。该注册表的开发顺应了该领域的需求,不仅提供了全球iBCI临床试验参与者的最新估计,还为临床医生、研究人员和监管机构提供了动态可更新的资源。我们计划持续更新和扩展该注册表,最终纳入开放访问数据集,以进一步促进合作研究,为监管决策提供信息,并加速iBCI技术的临床转化。注册表将持续更新和维护,研究者可提交表格分享其试验元数据、结局和任何相关引用。该注册表可免费访问ibciregistry.com。
9. 局限性
本综述有几个可能影响其发现的局限性。首先,所有纳入研究均以英文发表,这可能限制对全球iBCI研究贡献的理解。这对中国尤其重要,中国是全球自然科学研究的最大贡献者,按出版物数量计算[95]。中国也是BCI专利提交的第二常见司法管辖区[96]。这些研究大多发表在英文期刊上,并被本综述检索的主要数据库索引。然而,由于语言障碍,仍有可能遗漏一些研究[95,97]。
发表偏倚的可能性是另一个关键限制。绝大多数已发表研究是病例报告或病例系列,通常聚焦"表现最佳"的患者,这可能扭曲结局的代表性。此外,围绕iBCI技术的商业利益可能提供隐瞒技术和方法细节的动机。
最后,iBCI领域的快速发展可能限制我们综述发现的持久性,因为它们可能很快过时。为解决这一问题,我们纳入了未发表文献和近期进展的讨论,尽管这些未纳入正式分析。我们还推出了iBCI注册表,实现对全球iBCI临床试验参与者的动态更新估计。
结论
本系统综述强调了植入式 BCI 领域的快速演变。过去二十年见证了临床和技术重点的不断发展,大多数研究发表于美国,欧洲和中国也有重要贡献。传感技术取得了相当大的进步,包括 ECoG 与传统微电极阵列的使用增加。iBCIs 在通信速度方面取得了重大进展,现在超过了打字速度,接近人类自然对话的速度。此外,一系列可控制的效应器不断扩大,能够恢复广泛的日常生活活动。iBCI 设备的临床转化即将到来。然而,为了获得监管批准,开发和使用新型、临床相关的结局指标至关重要。
参考文献
1. J. D. Steinmetz, K. M. Seeher, N. Schiess, E. Nichols, B. Cao, C. Servili, V. Cavallera, E. Cousin, H. Hagins, M. E. Moberg, M. L. Mehlman, Y. H. Abate, J. Abbas, M. A. Abbasi, M. Abbasian, H. Abbastabar, M. Abdelmasseh, M. Abdollahi, M. Abdollahi, M.-A. Abdollahifar, R. AbdRabu, D. M. Abdulah, A. Abdullahi, A. Abedi, V. Abedi, R. A. Abeldano Zuniga, H. Abidi, O. Abiodun, R. G. Aboagye, H. Abolhassani, et al., Lancet Neurol. 2024, 23, 344.
2. M. Safdarian, E. Trinka, V. Rahimi-Movaghar, A. Thomschewski, A. Aali, G. G. Abady, S. M. Abate, F. Abd-Allah, A. Abedi, D. E. Adane, S. Afzal, B. O. Ahinkorah, S. Ahmad, H. Ahmed, N. Amanat, D. Angappan, J. Arabloo, A. Aryannejad, S. S. Athari, A. Atreya, S. Azadnajafabad, A. Y. Azzam, H. Babamohamadi, P. C. Banik, M. Bardhan, A. Bashiri, A. Y. Berhie, A. N. Bhat, J. Brown, A. P. Champs, et al., Lancet Neurol. 2023, 22, 1026.
3. M. Dijkers, Spinal Cord 1997, 35, 829.
4. D. S. Tulsky, P. A. Kisala, D. Victorson, D. G. Tate, A. W. Heinemann, S. Charlifue, S. C. Kirshblum, D. Fyffe, R. Gershon, A. M. Spungen, C. H. Bombardier, T. A. Dyson-Hudson, D. Amtmann, C. Z. Kalpakjian, S. W. Choi, A. M. Jette, M. Forchheimer, D. Cella, J. Spinal Cord Med. 2015, 38, 257.
5. S. Kalagi, J. Machado, V. Carvalho, F. Soares, D. Matos, 2017 Int. Conf. Engineering, Technology and Innovation (ICE/ITMC), IEEE, New York City, NY, USA, 2017, 1578.
6. T. Aflalo, S. Kellis, C. Klaes, B. Lee, Y. Shi, K. Pejsa, K. Shanfield, S. Hayes-Jackson, M. Aisen, C. Heck, C. Liu, R. A. Andersen, Science 2015, 348, 906.
7. C. Guan, T. Aflalo, K. Kadlec, J. Gámez de Leon, E. R. Rosario, A. Bari, N. Pouratian, R. A. Andersen, J. Neural Eng. 2023, 20, 036020.
8. A. Moly, T. Costecalde, F. Martel, M. Martin, C. Larzabal, S. Karakas, A. Verney, G. Charvet, S. Chabardes, A. L. Benabid, T. Aksenova, J. Neural Eng. 2022, 19, 26021.
9. N. P. Shah, M. S. Willsey, N. Hahn, F. Kamdar, D. T. Avansino, L. R. Hochberg, K. V. Shenoy, J. M. Henderson, Int. IEEE/EMBS Conf. Neural Engineering, IEEE, New York City, NY, USA, 2023.
10. A. Jorge, D. A. Royston, E. C. Tyler-Kabara, M. L. Boninger, J. L. Collinger, Neurosurgery 2020, 87, 630.
11. M. ´Sliwowski, M. Martin, A. Souloumiac, P. Blanchart, T. Aksenova, J. Neural Eng. 2022, 19, 026023.
12. M. J. Vansteensel, E. G. M. Pels, M. G. Bleichner, M. P. Branco, T. Denison, Z. V. Freudenburg, P. Gosselaar, S. Leinders, T. H. Ottens, M. A. Van Den Boom, P. C. Van Rijen, E. J. Aarnoutse, N. F. Ramsey, N. Engl. J. Med. 2016, 375, 2060.
13. D. M. Brandman, M. C. Burkhart, J. Kelemen, B. Franco, M. T. Harrison, L. R. Hochberg, Neural Comput 2018, 30, 2986.
14. V. Gilja, C. Pandarinath, C. H. Blabe, P. Nuyujukian, J. D. Simeral, A. A. Sarma, B. L. Sorice, J. A. Perge, B. Jarosiewicz, L. R. Hochberg, K. V. Shenoy, J. M. Henderson, Nat. Med. 2015, 21, 1142.
15. T. J. Oxley, P. E. Yoo, G. S. Rind, S. M. Ronayne, C. M. S. Lee, C. Bird, V. Hampshire, R. P. Sharma, A. Morokoff, D. L. Williams, C. MacIsaac, M. E. Howard, L. Irving, I. Vrljic, C. Williams, S. E. John, F. Weissenborn, M. Dazenko, A. H. Balabanski, D. Friedenberg, A. N. Burkitt, Y. T. Wong, K. J. Drummond, P. Desmond, D. Weber, T. Denison, L. R. Hochberg, S. Mathers, T. J. O"Brien, C. N. May, et al., J. Neurointerventional Surg. 2021, 13, 102.
16. S. Luo, M. Angrick, C. Coogan, D. N. Candrea, K. Wyse-Sookoo, S. Shah, Q. Rabbani, G. W. Milsap, A. R. Weiss, W. S. Anderson, D. C. Tippett, N. J. Maragakis, L. L. Clawson, M. J. Vansteensel, B. A. Wester, F. V. Tenore, H. Hermansky, M. S. Fifer, N. F. Ramsey, N. E. Crone, Adv. Sci. 2023, 10, 2304853.
17. S. L. Metzger, J. R. Liu, D. A. Moses, M. E. Dougherty, M. P. Seaton, K. T. Littlejohn, J. Chartier, G. K. Anumanchipalli, A. Tu-Chan, K. Ganguly, E. F. Chang, Nat. Commun. 2022, 13, 6510.
18. S. L. Metzger, K. T. Littlejohn, A. B. Silva, D. A. Moses, M. P. Seaton, R. Wang, M. E. Dougherty, J. R. Liu, P. Wu, M. A. Berger, I. Zhuravleva, A. Tu-Chan, K. Ganguly, G. K. Anumanchipalli, E. F. Chang, Nature 2023, 620, 1037.
19. D. A. Moses, S. L. Metzger, J. R. Liu, G. K. Anumanchipalli, J. G. Makin, P. F. Sun, J. Chartier, M. E. Dougherty, P. M. Liu, G. M. Abrams, A. Tu-Chan, K. Ganguly, E. F. Chang, N. Engl. J. Med. 2021, 385, 217.
20. L. R. Hochberg, M. D. Serruya, G. M. Friehs, J. A. Mukand, M. Saleh, A. H. Caplan, A. Branner, D. Chen, R. D. Penn, J. P. Donoghue, Nature 2006, 442, 164.
21. B. Wodlinger, J. E. Downey, E. C. Tyler-Kabara, A. B. Schwartz, M. L. Boninger, J. L. Collinger, J. Neural Eng. 2014, 12, 16011.
22. S. N. Flesher, J. L. Collinger, S. T. Foldes, J. M. Weiss, J. E. Downey, E. C. Tyler-Kabara, S. J. Bensmaia, A. B. Schwartz, M. L. Boninger, R. A. Gaunt, Sci. Transl. Med. 2016, 8, 361ra141.
23. B. O. Mainsah, L. M. Collins, K. A. Colwell, E. W. Sellers, D. B. Ryan, K. Caves, C. S. Throckmorton, J. Neural Eng. 2015, 12, 016013.
24. E. M. Holz, J. Höhne, P. Staiger-Sälzer, M. Tangermann, A. Kübler, Artif. Intell. Med. 2013, 59, 111.
25. J. R. Wolpaw, N. Birbaumer, D. J. McFarland, G. Pfurtscheller, T. M. Vaughan, Clin. Neurophysiol. 2002, 113, 767.
26. E. Musk, J. Med. Internet Res. 2019, 21, 16194.
27. A. Fry, H. W. Chan, N. Y. Harel, L. A. Spielman, M. X. Escalon, D. F. Putrino, J. Neural Eng. 2022, 19, 021001.
28. A. Sawyer, N. Chetty, D. P. McMullen, H. Dean, J. Eisler, M. FriedOken, L. R. Hochberg, C. Gibbons, K. E. Waite, T. Oxle, A. Fry, D. Weber, D. Putrino, J. Neural Eng. 2024, 22, 010201.
29. Public Workshop – Food and Drug Administration/National Institutes of Health Joint Workshop: Developing Implanted Brain– Computer Interface Clinical Outcome Assessments to Demonstrate Benefit, https://www.fda.gov/news-events/fda-meetingsconferences-and-workshops/public-workshop-food-and-drugadministrationnational-institutes-health-joint-workshop-developing (accessed: September 2024).
30. RFA-FD-23-030: Systematic Review of Clinical Outcome Assessments (COAs) for Communication Brain-Computer Interface Devices (cBCIs) in Amyotrophic Lateral Sclerosis (ALS) (UH2/UH3) Clinical Trials Not Allowed [Internet], https://grants.nih.gov/grants/guide/rfafiles/RFA-FD-23-030.html (accessed: September 2024).
31. M. J. R. Lim, J. Y. T. Lo, Y. Y. Tan, H.-Y. Lin, Y. Wang, D. Tan, E. Wang, Y. Y. Naing Ma, J. J. Wei Ng, R. A. Jefree, Y. Tseng Tsai, J. Neural Eng. 2025, 22, 26013.
32. M. J. Page, J. E. McKenzie, P. M. Bossuyt, I. Boutron, T. C. Hoffmann, C. D. Mulrow, L. Shamseer, J. M. Tetzlaff, E. A. Akl, S. E. Brennan, R. Chou, J. Glanville, J. M. Grimshaw, A. Hróbjartsson, M. M. Lalu, T. Li, E. W. Loder, E. Mayo-Wilson, S. McDonald, L. A. McGuinness, L. A. Stewart, J. Thomas, A. C. Tricco, V. A. Welch, P. Whiting, D. Moher, BMJ 2021, 372, n71.
33. B. Liu, H. Gao, Y. Jiang, J. Wu, Proc. 2023 4th Int. Symp. on Artificial Intelligence for Medicine Science, Association for Computing Machinery, New York City, NY, USA, 2024, 887.
34. O. Maslova, Y. Komarova, N. Shusharina, A. Kolsanov, A. Zakharov, E. Garina, V. Pyatin, Front. Hum. Neurosci. 2023, 17.
35. U. G. Hofmann, T. Stieglitz, Nat. Commun. 2024, 15, 6207.
36. J. M. Gaylor, G. Raman, M. Chung, J. Lee, M. Rao, J. Lau, D. S. Poe, JAMA Otolaryngol– Head Neck Surg. 2013, 139, 265.
37. F. Forli, E. Arslan, S. Bellelli, S. Burdo, P. Mancini, A. Martini, M. Miccoli, N. Quaranta, S. Berrettini, Acta Otorhinolaryngol. Ital. 2011, 31, 281.
38. M. Ouzzani, H. Hammady, Z. Fedorowicz, A. Elmagarmid, Syst. Rev. 2016, 5, 210.
39. H. Wickham, M. Averick, J. Bryan, W. Chang, L. McGowan, R. François, G. Grolemund, A. Hayes, L. Henry, J. Hester, M. Kuhn, T. Pedersen, E. Miller, S. Bache, K. Müller, J. Ooms, D. Robinson, D. Seidel, V. Spinu, K. Takahashi, D. Vaughan, C. Wilke, K. Woo, H. Yutani, J Open Source Software 2019, 4, 1686.
40. H. Wickham, Elegant Graphics for Data Analysis, Springer, New York City, NY, USA, 2009.
41. P. Lorenz-Spreen, L. Oswald, S. Lewandowsky, R. Hertwig, Nat. Hum. Behav. 2023, 7, 74.
42. S. E. John, N. L. Opie, Y. T. Wong, G. S. Rind, S. M. Ronayne, G. Gerboni, S. H. Bauquier, T. J. O’Brien, C. N. May, D. B. Grayden, T. J. Oxley, Sci. Rep. 2018, 8, 8427.
43. A. K.Palin, A. M. Feit, S. Kim, P. O. Kristensson, A. Oulasvirta, How do People Type on Mobile Devices? Observations from a Study with 37,000 Volunteers. [Internet]. ACM; 2019, https://www.repository. cam.ac.uk/handle/1810/302037.
44. F. R. Willett, E. M. Kunz, C. Fan, D. T. Avansino, G. H. Wilson, E. Y. Choi, F. Kamdar, M. F. Glasser, L. R. Hochberg, S. Druckmann, K. V. Shenoy, J. M. Henderson, Nature 2023, 620, 1031.
45. S. Chakrabarti, H. M. Sandberg, J. S. Brumberg, D. J. Krusienski, Biomed. Eng. Lett. 2015, 5, 10.
46. B. Maiseli, A. T. Abdalla, L. V. Massawe, M. Mbise, K. Mkocha, N. A. Nassor, M. Ismail, J. Michael, S. Kimambo, Brain Inf. 2023, 10, 20.
47. R. A. Miranda, W. D. Casebeer, A. M. Hein, J. W. Judy, E. P. Krotkov, T. L. Laabs, J. E. Manzo, K. G. Pankratz, G. A. Pratt, J. C. Sanchez, D. J. Weber, T. L. Wheeler, G. S. F. Ling, J. Neurosci. Methods 2015, 244, 52.
48. Investigational Device Exemption (IDE), https://www.fda.gov/ medical-devices/premarket-submissions-selecting-and-preparingcorrect-submission/investigational-device-exemption-ide (accessed: September 2024).
49. Brain–Computer Interface Export Controls for BCI Day 1 [Internet], https://www.bis.doc.gov/index.php/documents/pdfs/3246-braincomputer-interface-export-controls-for-bci-day-1 (accessed: August 2024).
50. P. Mitchell, S. C. M. Lee, P. E. Yoo, A. Morokoff, R. P. Sharma, D. L. Williams, C. MacIsaac, M. E. Howard, L. Irving, I. Vrljic, C. Williams, S. Bush, A. H. Balabanski, K. J. Drummond, P. Desmond, D. Weber, T. Denison, S. Mathers, T. J. O’Brien, J. Mocco, D. B. Grayden, D. S. Liebeskind, N. L. Opie, T. J. Oxley, B. C. V. Campbell, JAMA Neurol. 2023, 80, 270.
51. M. J. Vansteensel, S. Leinders, M. P. Branco, N. E. Crone, T. Denison, Z. V. Freudenburg, S. H. Geukes, P. H. Gosselaar, M. Raemaekers, A. Schippers, M. Verberne, E. J. Aarnoutse, N. F. Ramsey, N. Engl. J. Med. 2024, 391, 619.
52. Y. Chen, M. J. DeVivo, J. S. Richards, T. B. SanAgustin, Arch. Phys. Med. Rehabil. 2016, 97, 1797.
53. PRIME Study Progress Update — User Experience, https:// neuralink.com/blog/prime-study-progress-update-user-experience/ (accessed: September 2024).
54. Brain–computer interface makes breakthrough by deciphering Chinese speech in brain [Internet], https://www.chinadaily.com.cn/a/ 202501/03/WS67774792a310f1265a1d8ca2.html (accessed: January 2025).
55. M. Wairagkar, N. S. Card, T. Singer-Clark, X. Hou, C. Iacobacci, L. M. Miller, L. R. Hochberg, D. M. Brandman, S. D. Stavisky, Nature 2025, 607690, https://doi.org/10.1038/s41586-025-09127-3.
56. M. H. Barlek, J. R. Rouan, T. G. Wyatt, I. Helenowski, M. R. Kibbe, J. Surg. Res. 2022, 278, 364.
57. W. Ding, S. Hu, P. Wang, H. Kang, R. Peng, Y. Dong, F. Li, Spine 2022, 47, 1532.
58. Z. R. Manjaly, K. M. Scott, K. Abhinav, L. Wijesekera, J. Ganesalingam, L. H. Goldstein, A. Janssen, A. Dougherty, E. Willey, B. R. Stanton, M. R. Turner, M. A. Ampong, M. Sakel, R. W. Orrell, R. Howard, C. E. Shaw, P. N. Leigh, A.-A. Chalabi, Amyotrophic Lateral Scler. 2010, 11, 439.
59. J. Ospel, N. Singh, A. Ganesh, M. Goyal, J. Stroke 2023, 25, 16.
60. M. P. Branco, S. H. Geukes, E. J. Aarnoutse, N. F. Ramsey, M. J. Vansteensel, Eur. J. Neurosci. 2023, 57, 1260.
61. P. T. Wang, C. E. King, C. M. McCrimmon, J. J. Lin, M. Sazgar, F. P. Hsu, S. J. Shaw, D. E. Millet, L. A. Chui, C. Y. Liu, A. H. Do, Z. Nenadic, J. Neural Eng. 2016, 13, 026016.
62. P. Konrad, K. R. Gelman, J. Lawrence, S. Bhatia, D. Jacqueline, R. Sharma, E. Ho, Y. W. Byun, C. H. Mermel, B. I. Rapoport, J. Neural Eng. 2025, 22, 026009.
63. D. B. Silversmith, R. Abiri, N. F. Hardy, N. Natraj, A. Tu-Chan, E. F. Chang, K. Ganguly, Nat. Biotechnol. 2021, 39, 326.
64. F. R. Willett, D. T. Avansino, L. R. Hochberg, J. M. Henderson, K. V. Shenoy, Nature 2021, 593, 249.
65. C. Pandarinath, P. Nuyujukian, C. H. Blabe, B. L. Sorice, J. Saab, F. R. Willett, L. R. Hochberg, K. V. Shenoy, J. M. Henderson, eLife 2017, 6, 18554.
66. S. Kellis, K. Miller, K. Thomson, R. Brown, P. House, B. Greger, J. Neural Eng. 2010, 7, 056007.
67. K. E. Bouchard, D. F. Conant, G. K. Anumanchipalli, B. Dichter, K. S. Chaisanguanthum, K. Johnson, E. F. Chang, PLoS One 2016, 11, 0151327.
68. Toward an integrated understanding of speaking rate in conversation, https://www.isca-archive.org/interspeech_2006/yuan06_ interspeech.html (accessed: December 2024).
69. M. Jamali, B. Grannan, J. Cai, A. R. Khanna, W. Muñoz, I. Caprara, A. C. Paulk, S. S. Cash, E. Fedorenko, Z. M. Williams, Nature 2024, 631, 610.
70. J. Zheng, M. Meister, Neuron 2025, 113, 192.
71. H. Lorach, A. Galvez, V. Spagnolo, F. Martel, S. Karakas, N. Intering, M. Vat, O. Faivre, C. Harte, S. Komi, J. Ravier, T. Collin, L. Coquoz, I. Sakr, E. Baaklini, S. D. Hernandez-Charpak, G. Dumont, R. Buschman, N. Buse, T. Denison, I. van Nes, L. Asboth, A. Watrin, L. Struber, F. Sauter-Starace, L. Langar, V. Auboiroux, S. Carda, S. Chabardes, T. Aksenova, et al., Nature 2023, 618, 126.
72. M. Hettick, E. Ho, A. J. Poole, M. Monge, D. Papageorgiou, K. Takahashi, M. LaMarca, D. Trietsch, K. Reed, M. Murphy, S. Rider, K. R. Gelman, Y. W. Byun, T. Hanson, V. Tolosa, S.-H. Lee, S. Bhatia, P. E. Konrad, M. Mager, C. H. Mermel, B. I. Rapoport, bioRxiv 2024, 474656.
73. A. Rani, Med. Device Network 2024, https://www.medicaldevicenetwork.com/news/precision-brain-sites/.
74. Y. Zhou, M. A. Chia, S. K. Wagner, M. S. Ayhan, D. J. Williamson, R. R. Struyven, T. Liu, M. Xu, M. G. Lozano, P. Woodward-Court, Y. Kihara, N. Allen, J. E. J. Gallacher, T. Littlejohns, T. Aslam, P. Bishop, G. Black, P. Sergouniotis, D. Atan, A. D. Dick, C. Williams, S. Barman, J. H. Barrett, S. Mackie, T. Braithwaite, R. O. Carare, S. Ennis, J. Gibson, A. J. Lotery, J. Self, et al., Nature 2023, 622, 156.
75. J. Abramson, J. Adler, J. Dunger, R. Evans, T. Green, A. Pritzel, O. Ronneberger, L. Willmore, A. J. Ballard, J. Bambrick, S. W. Bodenstein, D. A. Evans, C.-C. Hung, M. O’Neill, D. Reiman, K. Tunyasuvunakool, Z. Wu, A. Zemgulyte, E. Arvaniti, C. Beattie, O. Bertolli, A. Bridgland, A. Cherepanov, M. Congreve, A. I. Cowen-Rivers, A. Cowie, M. Figurnov, F. B. Fuchs, H. Gladman, R. Jain, et al., Nature 2024, 630, 493.
76. Y. Benchetrit, H. Banville, J. R. King, arXiv 2024, arXiv:2310.19812.
77. E. Howcroft, E. Howcroft, Reuters https://www.reuters.com/ technology/crypto-company-tether-invests-200-mln-brain-chipmaker-blackrock-neurotech-2024-04-29/ (accessed: 2024).
78. Musk’s Neuralink raises $280 mln in funding led by Thiel’s Founders Fund, https://www.reuters.com/technology/musks-neuralinkraises-280-mln-latest-fundraise-2023-08-07/ (accessed: December 2024). 79. Synchron raises US$75m Series C funding to advance endovascular brain–computer interface, https://eng.unimelb.edu.au/ ingenium/university-of-melbourne-professors-start-up-synchronraises-us$75m-series-c-funding-to-advance-endovascular-braincomputer-interface (accessed: December 2024).
80. ARPA-H funds project to develop treatments for neurodegenerative diseases | ARPA-H [Internet], https://arpah.gov/news-and-events/arpa-h-funds-project-develop-treatmentsneurodegenerative-diseases (accessed: May 2025).
81. ARIA. Precision Neurotechnologies for Human Therapeutics — Call for proposals (accessed: July 2024).
82. https://t.co/OMIeGGjYtG [Internet], https://x.com/neuralink/ status/1770563939413496146 (accessed: May 2025).
83. K. M. Patrick-Krueger, I. Burkhart, J. L. Contreras-Vidal, Nat. Rev. Bioeng. 2024, 3, 50.
84. Advanced Research and Invention Agency (ARIA), Policy Statement., https://www.gov.uk/government/publications/advanced-researchand-invention-agency-aria-statement-of-policy-intent/advancedresearch-and-invention-agency-aria-policy-statement (accessed: September 2024).
85. Department of Health and Human Services. Fiscal Years 2024–2026 Presidential Budget Request. Advanced Research Projects Agency for Health Strategic Plan, 2024.
86. J. F. M. Brannigan, K. Liyanage, H. L. Horsfall, L. Bashford, W. Muirhead, A. Fry, J. Neural Eng. 2024, 21, 61005.
87. FDA, Research C for DE and. Patient-Focused Drug Development: Selecting, Developing, or Modifying Fit-for-Purpose Clinical Outcome Assessments [Internet], https://www.fda.gov/regulatoryinformation/search-fda-guidance-documents/patient-focuseddrug-development-selecting-developing-or-modifying-fit-purposeclinical-outcome (accessed: May 2025).
88. L. A. Simpson, J. J. Eng, J. T. C. Hsieh, D. L. Wolfe, J. Neurotrauma 2012, 29, 1548.
89. M. D. Serruya, A. Napoli, N. Satterthwaite, J. Kardine, J. McCoy, N. Grampurohit, K. Talekar, D. M. Middleton, F. Mohamed, M. Kogan, A. Sharan, C. Wu, R. H. Rosenwasser, Commun. Med. 2022, 2, 37.
90. Z. Simmons, Neurother. J. Am. Soc. Exp. Neurother. 2015, 12, 394.
91. M. Calvert, J. Blazeby, D. G. Altman, D. A. Revicki, D. Moher, M. D. Brundage, JAMA, J. Am. Med. Assoc. 2013, 309, 814.
92. M. Bédard, D. W. Molloy, L. Squire, S. Dubois, J. A. Lever, M. O’Donnell, Gerontologist 2001, 41, 652.
93. K. A. O’Malley, S. H. Qualls, Clin. Gerontol. 2017, 40, 281.
94. A. Sawyer, L. Cooke, N. F. Ramsey, D. Putrino, J. NeuroInterventional Surg. 2024, 16, 443.
95. S. Baker, Nature 2023, https://www.nature.com/articles/d41586023-01705-7.
96. A. Greenberg, A. Cohen, M. Grewal, Nat. Biotechnol. 2021, 39, 1194.
97. B. Owens, Nature 2024, 630, S2.

文献 DOI:https://doi.org/10.1002/advs.202501912
脑机接口产业联盟作为脑机接口的合作与促进平台,着力聚集产业界各方资源,共同致力于推进脑机接口产业发展、需求与架构、标准、产品、解决方案及应用推广,形成良好的合作氛围及协作机制,围绕产业链,协调组织关键问题研究和核心技术攻关,促进产业生态繁荣,为中国及全球脑机接口产业发展提供必要支撑。
加入方式
关注脑机接口产业联盟公众号,菜单栏获取联盟加入申请表格,材料齐全后发秘书处。
欢迎业界积极参与联络,联系邮箱:bcia@caict.ac.cn。

(扫码获取加入联盟的申请材料)