文献速递

作者:Xing Qian, Kwun Kei Ng, Si Ning Yeo, Yng Min Loke, Yin Bun Cheung , Lei Feng, Mei Sian Chong, Tze Pin Ng, K. Ranga Rama Krishnan, Cuntai Guan, Thi-Shih Lee, Juan Helen Zhou
摘要
基于脑机接口(BCI)的认知训练系统在增强认知正常老年人的认知表现方面显示出潜力。然而,这些行为改善背后的大脑网络变化仍知之甚少。为填补这一空白,我们使用静息态功能磁共振成像(rs-fMRI)和图论分析,研究了基于BCI的训练后认知正常老年人内在脑功能网络的拓扑结构改变及其行为相关性。与非干预等待列表(WL)组相比,干预(INT)组并未显示出显著的行为改善。然而,他们表现出大脑网络组织的积极变化。具体而言,INT组表现出降低的节点参与系数,表明节点在其社区内的连接强度增强,这主要发生在控制网络和皮层下网络内,并且训练后系统分离性增加。此外,与WL组相比,INT组脑功能网络的模块化组织变得更加分离,并且更接近于基于年轻人的分区模板(使用调整兰德指数进行量化)。重要的是,参与系数的降低,特别是在皮层下区域,与语言能力的改善相关,而调整兰德指数的增加则与日常记忆功能的增强相关。这些发现表明,基于BCI的认知训练可能通过增强功能网络分离,有助于维持认知正常衰老过程中的大脑网络组织,从而潜在地支持认知表现。本研究为理解基于BCI的认知训练对认知正常衰老有效性的神经机制提供了见解。
关键词: 功能磁共振成像;基于脑机接口的干预;网络;功能连接;衰老;老年人
重要观点 (Key Points)
在认知正常的老年人中,基于脑机接口(BCI)的认知干预(INT)后,脑功能网络分离性得到改善。
干预后,大脑的功能模块化组织变得更类似于年轻健康成年人的模式。
这些功能网络组织的改变与认知正常老年人认知表现的变化相关。
引言
人口老龄化是当今最显著的社会趋势之一[1]。正常衰老与认知能力下降相关,包括处理速度、记忆、语言、视觉空间功能和执行功能,这可能对老年人的日常功能和生活质量产生不利影响[2]。过去几十年,研究人员越来越关注非药物性认知训练方法,以保持老龄人口的认知活力[3, 4]。
基于脑电图(EEG)的神经反馈系统通过实时调节神经活动以增强大脑功能,已显示出改善健康老年人认知表现的潜力[5–7]。一些研究假设这些系统可以通过靶向EEG信号诱导训练特异性的神经可塑性和行为改善[8–10]。一个个性化的基于脑机接口(BCI)的神经反馈系统被设计用于训练健康老年人的注意力和工作记忆[5]。该系统让用户参与认知训练游戏,其中反馈反映了他们测量的专注水平,并利用虚拟场景来增强现实生活的可转移性并维持长期参与的动机。这种基于BCI的训练已证明能获得认知表现上的收益,特别是在男性的延迟记忆和语言方面,表明其作为健康衰老认知训练工具的潜力。这些改善被认为源于训练诱导的神经可塑性[9, 11]。
无创神经成像方法,如静息态功能磁共振成像(rs-fMRI),为在宏观水平上利用大规模功能网络表征大脑可塑性开辟了新途径,并为理解认知衰退和增强的机制提供了见解。静息态功能连接(FC)测量的是在无任务条件下大脑区域之间低频血氧水平依赖(BOLD)信号波动的同步性[12],它 consistently 揭示了几个扮演不同功能角色的内在连接网络(ICN)[13, 14]。先前的ICN研究表明,人脑被组织成一个分层的模块化结构,紧密连接的区域形成功能模块,模块之间的连接稀疏,反映了功能专业化和分离[15–17]。这种组织支持模块内的专门化处理,同时减少干扰,从而促进认知表现[18]。
正常衰老与大脑网络的重组有关,包括功能专业化和分离性的降低,即使在没有神经退行性疾病的情况下也是如此[19, 20]。重要的是,这些大脑变化与衰老过程中的认知表现下降相关[21–24]。研究表明,默认模式网络(DMN)和执行控制网络(ECN)的功能专业化存在与年龄相关的下降,DMN-ECN分离性的降低与处理速度变慢相关[21]。衰老还导致初级处理和背侧注意网络内部连接性减弱,这与一般认知表现相关[24]。此外,应用图论分析(一种在区域和系统层面阐明复杂网络组织的强大工具[25])进一步揭示了与年龄相关的、朝向更整合的大脑网络拓扑结构的转变[24]。老年人表现出较低的局部效率,表明分离性处理减少,以及在控制网络和背侧注意网络中较高的参与系数,反映了整合性处理增加[22]。
尽管基于BCI的认知训练在改善老年人认知表现方面显示出潜力,但人们对其对大脑网络组织的影响知之甚少。为填补这一空白,我们旨在使用rs-fMRI和图论分析,研究基于BCI的训练后认知正常老年人内在脑功能网络的拓扑结构改变及其行为相关性。基于先前关于衰老过程中功能专业化和分离性降低的发现,我们假设BCI训练将增强功能分离性和专业化,特别是在核心神经认知和皮层下网络中。此外,我们试图检验这些拓扑变化是否与认知表现的改善相关。
方法
1. 参与者
一项单中心随机对照试验招募了227名60-80岁的参与者。所有参与者的临床痴呆评定量表(CDR)[26]得分为0-0.5,简易精神状态检查(MMSE)[27]得分为24分或以上,老年抑郁量表(GDS)[28]得分为4分或以下。参与者无神经精神疾病史,无未矫正的听力、视觉或言语障碍,无色盲,且未使用如利斯的明、多奈哌齐、加兰他敏或美金刚等药物。所有参与者在签署知情同意书并接受研究方案前都得到了研究的详细解释。
表 1. 参与者的人口统计学、影像学信息和神经心理学评估
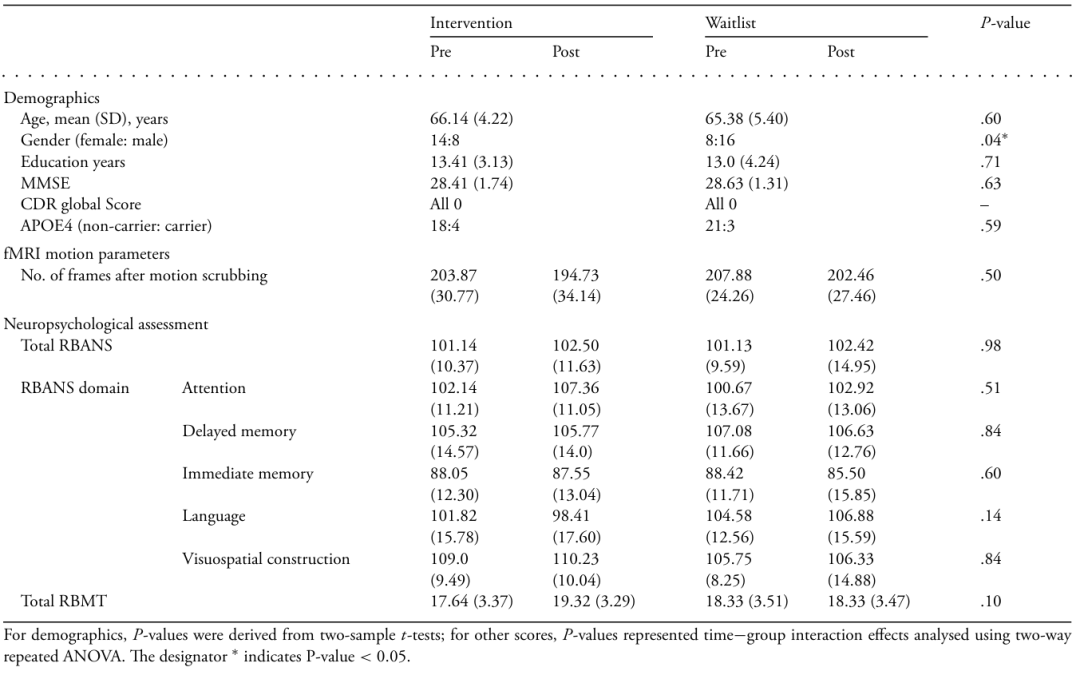
对于人口统计学,PP值来自双样本t检验;对于其他分数,PP值代表时间×组别交互效应,使用双向重复测量方差分析进行分析。* 表示 PP值 < 0.05。
参与者被随机分配到两组之一:干预(INT)组或等待列表(WL)组。INT组接受为期8周的基于BCI的认知训练,而WL组在此期间遵循他们的常规生活,不接受任何INT。一部分参与者在基线和8周后(随访)自愿接受了rs-fMRI扫描。影像学研究的最终样本包括INT组的40名参与者和WT组的38名参与者。经过严格的质量控制,28名INT参与者和28名WL参与者在两个时间点都有良好的结构和功能MRI数据。为确保参与者认知功能完整,CDR = 0.5的参与者被进一步排除。CDR分数为0.5通常被认为表示主观记忆抱怨和轻度认知障碍。这最终得到用于影像分析的样本:INT组22名参与者(年龄66.1 ± 4.2岁,14名女性)和WL组24名参与者(年龄65.4 ± 5.4岁,8名女性)(主要数据集;表1)。为验证研究结果,我们使用包含CDR = 0.5参与者的更广泛样本(INT组28人,WL组28人)进行了相同的分析(验证数据集;附录1 补充表1)。验证数据集使我们能够检验在主要数据集中观察到的主要效应和模式在纳入更多具有轻微认知困难的个体时是否仍然存在。
2. 基于BCI的干预程序
INT组的参与者进行了为期8周、每周三次的训练课程(图1)。BCI INT使用BRAINMEM认知训练系统进行(参见先前工作[5]),参与者佩戴带有干性EEG电极的可调节BCI头带控制电脑游戏。在训练课程开始前,参与者完成了一个颜色Stroop任务校准[29],该校准生成了一个个性化的EEG配置文件,用于后续训练中的神经反馈。每次课程持续40分钟,包括几轮游戏,由三个部分组成:购物清单、卡片匹配和购物清单回忆。这些任务针对注意力、工作记忆和延迟回忆。随着训练的进行,参与者练习调节他们的注意力,使购物清单项目更清晰,卡片打开或关闭更快。他们还制定了记忆和回忆物品、卡片和人脸的策略。
3. 神经心理学测量
神经心理学评估,包括可重复成套神经心理状态测验(RBANS)[30]和Rivermead行为记忆测验(RBMT-II)[31],在基线和8周后进行。RBANS是一个经过充分验证且可靠的认知筛查组合,用于评估注意力、延迟记忆、即时记忆、语言和视觉空间建构。RBMT-II通过模拟现实生活任务来检测日常记忆功能。疗效结果由RBANS总分、RBMT-II总量表分以及五个RBANS领域分数从基线到INT参与者完成8周INT后的变化来定义。

图 1. 研究设计示意图。
(A) 参与者被随机分配到INT组或WL组。两组在基线和随访时都完成了rs-fMRI和神经心理学评估。INT组接受了为期8周的基于BCI的认知训练计划(每周三次),而WL组在研究期间未接受任何INT。
(B) 在两个时间点为144个脑区ROI构建了FC矩阵。计算了关键的拓扑指标,包括参与系数和系统分离性。应用社区检测来识别模块结构,并用其计算额外的指标,包括个体模块化组织与基于年轻人的144-ROI分区模板的相似性(调整兰德指数)。然后使用这些指标来检查基于BCI的INT对脑网络的影响以及脑-行为关联。
4. 影像采集与预处理
所有MRI图像均在新加坡国立大学转化磁共振研究中心使用3-T Prisma扫描仪(Siemens, Germany)的20通道头线圈采集。静息态功能性和结构性MRI图像均采用我们先前研究[32]的标准流程进行预处理。进行了运动擦除以最小化脑网络中的虚假FC。有关MRI参数和预处理的更多细节在附录1补充方法中描述。
5. 拓扑指标与模块化社区检测
我们使用一个基于rs-fMRI的144个ROI脑功能分区方案提取了感兴趣区域(ROI)时间序列[32, 33]。该分区源自1000名健康年轻人,允许将ROI分组为七个内在连接网络(默认模式网络、ECN、显著性/腹侧注意网络、背侧注意网络、躯体运动网络、视觉网络和边缘网络)以及30个皮层下区域,形成一个皮层下网络。使用所有ROI对之间的Pearson相关性,然后进行Fisher的 r−to−z 转换[32],为每个个体在每个时间点生成一个FC矩阵。
为表征脑网络拓扑结构,我们从个体FC矩阵中导出了图论指标,包括节点参与系数(衡量一个区域跨所有系统的连接多样性)和全局系统分离性(量化系统间连接相对于系统内连接的比例)[19, 34](图1B)。仅考虑FC矩阵中的正值,负值设为零。为确保结果不依赖于特定网络密度阈值的选择,我们从各种网络密度阈值(10%-40%,步长1%)的FC矩阵中导出拓扑度量,然后对所有阈值进行整合以进行统计分析[32]。每个节点的参与系数根据以下公式计算[34]:

其中M是大脑系统(或模块)的数量,ki(m) 是节点 i 与系统 m (节点 i 不属于该系统)中节点的加权连接数,ki 是节点 i 的总加权连接数。高参与系数表明一个节点均匀地跨多个模块连接,充当整合枢纽,而低参与系数表明节点的连接主要限制在其自身模块内,反映了功能专业化。系统分离性取系统内平均连接与系统间平均连接之差占系统内平均连接的比例,如下列公式所示[19]:

其中  是系统内平均连接性,
是系统内平均连接性, 是系统间平均连接性。更高的系统分离性反映了功能系统内部更强的内部一致性以及不同系统之间更弱的连接性,表明更大的网络专业化和功能分化。
是系统间平均连接性。更高的系统分离性反映了功能系统内部更强的内部一致性以及不同系统之间更弱的连接性,表明更大的网络专业化和功能分化。
为最小化应用源自年轻人的分区模板带来的潜在偏差,我们额外使用完全数据驱动的方法识别了脑模块化组织及其与INT相关的改变,然后基于此数据驱动的模块结构评估相同的拓扑指标。为推导数据驱动的脑网络社区结构,我们使用了Louvain方法,随后是基于共识的聚类方法[35, 36]。对于每个个体在每个时间点,使用Louvain方法[37]在各种阈值(前10%-40%,步长0.1%;总共301个阈值)下进行模块社区划分。构建了一个共分类矩阵,其中每个元素代表给定一对脑节点被分配到同一社区的301次中的比例。然后对此共分类矩阵执行基于共识的聚类方法[35],收敛到一个单一的最终共识分区。然后我们使用相同的步骤为四个组(INT前、INT后、WL前、WL后)中的每一个生成具有代表性的组水平社区结构,即在组水平忠诚度矩阵上执行社区检测,该矩阵是通过汇总组中所有个体的共识社区分配创建的[36]。使用范围从1到6的 y 参数(分辨率参数 yy 决定检测到的社区数量)在个体水平和组水平进行社区检测。较大的 yy 值使算法偏向于检测较小的社区。我们报告了使用个体水平 y=3和组水平 y=3 的发现,因为用这两个参数导出的脑网络社区最能反映先前文献中描述的年轻人的规范网络组织[22, 33, 36]。
我们使用调整兰德指数来量化个体水平社区分配与标准144-ROI分区模板之间的一致性[36]。为验证,还计算了基于检测到的组水平模块结构的相同拓扑指标。
6. 统计分析
为评估8周时INT组与WL组相比的行为改善,我们对RBANS总分、RBMT-II总分和RBANS领域分数进行了双向重复测量方差分析(ANOVA)。
为检查潜在的组别(INT vs. WL)和时间(INT前 vs. INT后)交互效应对拓扑指标的影响,我们对系统分离性和参与系数进行了双向重复测量ANOVA,并使用置换检验(5000次置换,α=0.05)。年龄、性别和受教育年限作为协变量纳入。应用错误发现率(FDR)方法进行多重比较校正。对调整兰德指数进行了相同的分析,以检查模块化组织的变化。
最后,我们使用Pearson相关分析来检验拓扑指标的变化是否与随时间推移的认知改善相关。这包括RBANS总分、RBMT-II总分以及RBANS延迟记忆和语言领域的变化,这些在先前仅行为学的试验中已被证明对BCI INT有反应[5]。
结果
1. 人口统计学和基线特征
在主要数据集中,INT组和WL组在人口统计学变量上无显著差异,包括年龄、受教育年限、MMSE分数、CDR全局分数、APOE4基因型分布或影像学指标(例如,体积数)(表1)。与WL组相比,INT组女性比例相对较高。验证数据集的人口统计学详细信息在附录1补充表1中提供。
2. 基于BCI干预后的行为变化
在经过8周的基于BCI的INT后,在神经影像亚组中,RBANS或RBMT总分以及任何RBANS领域分数上均未发现显著的组别×时间交互效应(表1)。
3. 与基于BCI干预相关的脑网络重组
BCI INT后,与WT组相比,INT组表现出降低的节点参与系数,主要在ECN和皮层下网络中(FDR校正后 P<.05;图2A和B),以及增加的系统分离性(P<.05;图2C)。这些变化表明INT后网络专业化和功能分离性增强。值得注意的是,参与系数降低更多的参与者,特别是在皮层下区域,表现出更大的语言分数改善(P<.05;图2D和E)。
在包含CDR全局分数为0.5的参与者的更大数据集中也观察到了类似的结果(附录1补充图2)。
4. 基于BCI干预改善脑模块化结构
INT组脑功能网络的模块结构在BCI INT后变得更加分离(图3A–D),并且与基于年轻人的分区模板的相似性增加,表现为与WL组相比调整兰德指数更高(P<.05;图3E)。具体而言,INT组在INT后ECN和默认模式网络都显示出整合性增加,而WL组未观察到这种变化。模块结构 alignment 与基于年轻人的分区模板的一致性增加(通过兰德指数测量)与评估日常记忆功能的RBMT总分改善相关(r=0.31,P=.039;图3F)。
当使用检测到的模块社区结构而非标准模板计算拓扑指标时,关键发现(包括降低的节点参与系数和增加的系统分离性)保持一致(附录1补充图1)。
包含CDR全局分数为0.5的参与者的更大验证数据集产生了类似的发现(附录1补充图3和补充图4),表明观察到的效应并不仅仅依赖于较小的、严格定义的认知正常影像亚组,也可能扩展到患有轻度认知障碍的老年人。
讨论
我们提供了证据表明基于BCI的认知训练在认知正常老年人中诱导了脑网络重构。在INT之后,尽管行为改善不显著,但INT组表现出增强的脑网络功能专业化和分离性。这体现在增加的系统分离性和降低的节点参与系数上,特别是在ECN和皮层下网络内。此外,功能网络的模块化组织变得更加分离,并且更接近于基于年轻人的分区模板。重要的是,这些功能网络的变化与认知表现的改善相关,特别是在语言和日常记忆功能方面。这些发现强调了网络敏感性神经成像方法在揭示与认知正常衰老中认知训练相关的脑可塑性机制方面的效用。
尽管神经影像亚组未显示出整体认知表现或个别领域(如注意力或延迟记忆)的显著改善,这可能归因于相对较小的样本量和INT持续时间较短。值得注意的是,在更大的行为试验中,观察到了认知表现的收益,特别是在男性中,在包括延迟记忆和语言在内的领域[5]。这些发现突出了BCI系统潜在的特异性性别效应,并表明其在认知正常老年人,特别是男性中,进行安全且可接受的认知训练的实用性。认知表现上的性别差异很可能是历史社会人口因素与性激素相互作用,以及男女大脑结构差异的结果[5]。最近的研究表明,与认知正常的男性相比,认知正常的女性在衰老过程中往往表现出更差的静息态功能网络拓扑和连接性,以及更快的脑功能变化速率,这可能导致她们对认知障碍的易感性不同[38, 39]。最终,虽然对于此INT中观察到的性别相关效应存在多种可能的解释,但在更大、更平衡的样本中检查性别特异性的脑网络变化至关重要。
尽管本研究缺乏显著的行为结果,但神经影像分析揭示了强大的功能网络重组。执行控制和皮层下网络内的节点表现出降低的参与系数,表明这些节点的连接更多地包含在各自的系统内。此外,数据驱动的模块化社区检测显示ECN和默认模式网络(DMN)内的整合性增加,反映了增强的功能专业化。ECN和DMN是具有不同作用的核心神经认知网络;DMN支持内部导向的思维和自传体记忆,而ECN促进需要高认知需求或控制的外部导向过程[40]。这些系统之间的功能竞争(通过它们的反相关活动证明)被认为可以优化认知表现[41, 42]。先前的研究已将ECN和DMN内部功能整合的中断以及这些系统之间分离性的降低与认知衰退联系起来[21, 22, 43]。我们的发现表明,基于BCI的训练可能恢复DMN和ECN之间的系统间竞争,潜在地支持认知正常老年人的认知弹性。
观察到的皮层下参与系数的降低与参与者语言分数的改善相关。虽然效应量中等,但它们与先前关于衰老的fMRI研究报告的效应量相当[23, 44, 45]。值得注意的是,这些关联是基于纵向变化,这有助于减轻年龄、脑测量值和认知表现之间的共享方差,从而提供更具体和更有意义的脑-行为关系表征[46, 47]。皮层下结构如基底节和丘脑在语言处理中起着至关重要的作用[48, 49, 50],通过与前额叶、前运动、顶叶和颞叶皮层的环路与皮层区域相互作用[51, 48]。基于任务的fMRI研究表明,这些皮层下区域在语言任务期间被激活[52],它们的连接中断与语言障碍相关[50]。我们的发现强调了皮层下功能专业化在健康衰老中维持语言功能的重要性。
正常衰老与脑网络的模块化和分层组织衰退相关,其特征是网络内连接性减少和网络间连接性增加,以及系统分离性降低和“富俱乐部”组织程度降低[53]。
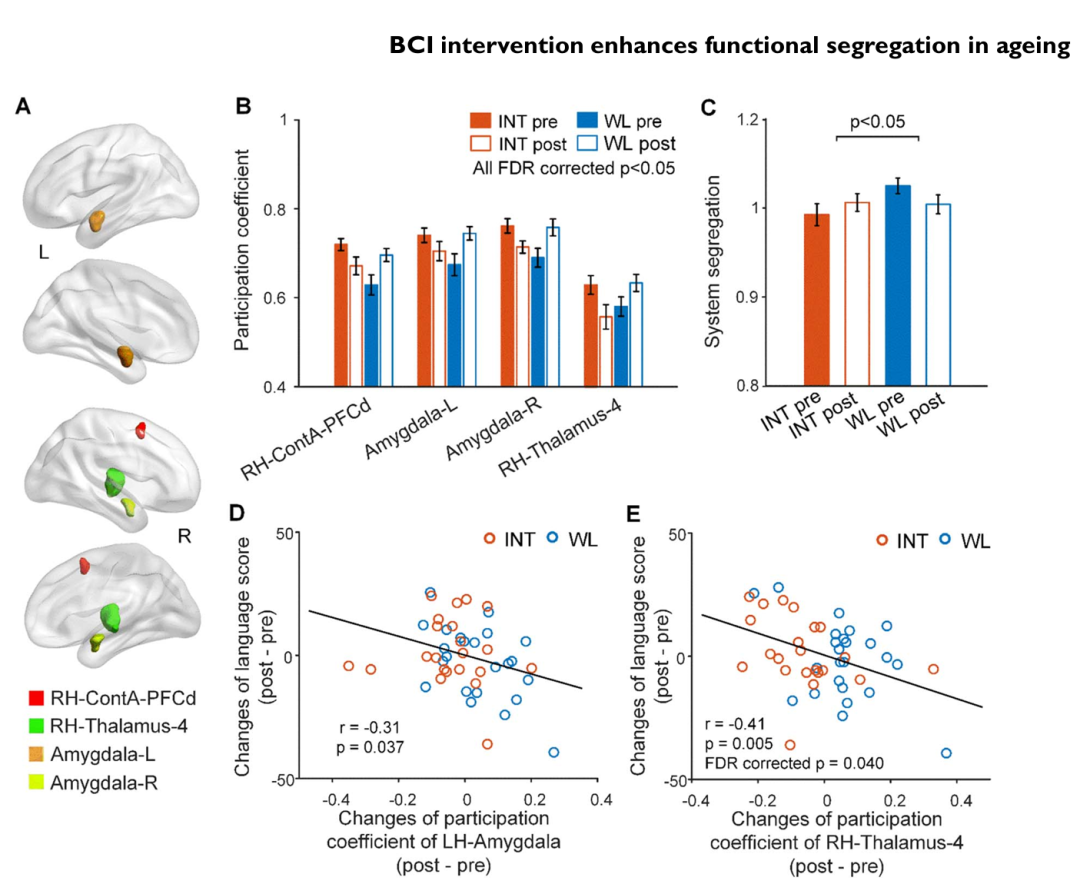
图2: 基于BCI的INT与健康老年人脑网络重组支持行为改善相关。
(A 和 B) 显示参与系数存在显著组别-时间交互效应的脑节点,主要位于ECN和皮层下网络内(FDR校正后 P<.05)。
(C) 全脑系统分离性表现出显著的组别-时间交互效应(P<.05)。
(D 和 E) 节点参与系数的变化,特别是在皮层下区域,与参与者语言表现的改善显著相关(P<.05)。所有面板中的误差线代表标准误。

图 3. 健康老年人在基于BCI的INT后网络结构的改变。
共识矩阵显示了每组和各时间点的模块社区结构:
(A) 基线时的INT组,(B) INT后的INT组,
(C) 基线时的WL组,和 (D) 等待期后的WL组。同一社区内的节点通过相同颜色的边连接,突出了模块化组织。
(E) 检测到的模块架构与144区域分区模板之间的相似性,使用调整兰德指数评估,揭示了显著的组别-时间交互效应(P<.05)。误差线代表标准误。
(F) 调整兰德指数的变化与RBMT总分的改善呈正相关。
这种变化与认知衰退相关[46]。在我们的研究中,INT组的参与者表现出增加的系统分离性以及与基于年轻人的功能分区模板的模块化相似性,反映了向更分离和更年轻化的脑网络配置的转变。相比之下,WL组的参与者没有显示出这种改善,其中一些遵循类似于正常衰老相关网络退化的轨迹。重要的是,模块化变化与日常记忆功能的改善相关,表明基于BCI的训练可能有助于减轻或延迟衰老相关的脑网络退化。
虽然衰老的大脑不可避免地经历结构和功能完整性的下降,但越来越多的研究表明,老年人仍然可以从生活方式INT中受益,例如有氧运动和饮食调整[54]。此外,某些类型的认知训练策略已显示出持久的效果和对未训练任务的强大近迁移益处[55, 56]。例如,Requena等人[55]发现,一个为期6年的扩展记忆训练计划显著改善了日常记忆和心理能力分数,突出了通过持续练习获得持续认知益处的潜力。此外,Grönholm-Nyman等人[56]报告称,一个为期5周的强化定势转换训练计划导致在训练任务上产生持久的改善(长达1年)。虽然我们的研究没有提供长期结果的直接证据,但观察到的脑网络变化,特别是增加的网络分离性,可能反映了神经可塑性适应;这种适应可能通过支持更高效和专门化的神经处理,帮助随时间推移保持认知功能,从而有助于长期对抗年龄相关衰退的认知弹性[57, 58, 59]。然而,需要未来的纵向研究来检验这些假设,并评估观察到的对基于BCI的INTs的神经变化的持久性。
本研究有几个局限性。首先,在排除因运动伪影导致数据质量差的参与者后,样本量相对较小。其次,虽然更大的行为试验显示了性别特异性的改善[5],但由于样本量有限,我们未检查性别对脑网络重组的影响。观察到的性别差异凸显了未来研究需要将性别作为分析脑网络对INT反应的一个因素。此外,需要更长期的基于BCI的认知训练计划和长期随访评估来评估这些效应的可持续性。
总之,我们的发现提供了初步证据,表明基于BCI的认知训练可能通过增强脑网络功能分离性来促进健康衰老,并具有帮助预防或减缓网络退化的潜力。这些结果为了解基于BCI的认知INTs背后可能的神经机制提供了见解,并表明这种方法在经过进一步验证后,可以在支持老年人认知功能方面发挥作用。
参考文献
1. Zhou C. The world aging population trend and policy practice. _Front Humanit Soc Sci_ 2021;1:132–8.
2. Harada CN, Love MCN, Triebel KL. Normal cognitive aging. _Clin Geriatr Med_ 2013;29:737–52. https://doi.org/10.1016/j.cger.2013.07.002.
3. Williams KN, Kemper S. Interventions to reduce cognitive decline in aging. _J Psychosoc Nurs Ment Health Serv_ 2010;48:42–51. https://doi.org/10.3928/02793695-20100331-03.
4. Kumar PV, Subramaniam P, Din NC. The utility and cultural specificity of cognitive-based interventions in preventing cognitive decline among healthy older adults in Asia: a systematic review. *Asian J Psychiatr* 2021;60:102646. https://doi.org/10.1016/j.ajp.2021.102646.
5. Yeo SN, Lee TS, Sug WT et al. Effectiveness of a personalized brain-computer interface system for cognitive training in healthy elderly: a randomized controlled trial. *J Alzheimer's Dis* 2018;66:127–38. https://doi.org/10.3233/JAD-180450.
6. Jiang Y, Abiri R, Zhao X. Tuning up the old brain with new tricks: attention training via neurofeedback. *Front Aging Neurosci* 2017;9:52.
7. Hohenfeld C, Kuhn H, Muller C et al. Changes in brain activation related to visuo-spatial memory after real-time fMRI neurofeedback training in healthy elderly and Alzheimer's disease. *Behav Brain Res* 2020;381:112435. https://doi.org/10.1016/j.bbr.2019.112435.
8. Leung NT, Tam HMK, Chu LW et al. Neural plastic effects of cognitive training on aging brain. *Neural Plast* 2015;2015:1–9. https://doi.org/10.1155/2015/535618.
9. Lampit A, Hallock H, Suo C et al. Cognitive training-induced short-term functional and long-term structural plastic change is related to gains in global cognition in healthy older adults: a pilot study. *Front Aging Neurosci* 2015;7:14.
10. Willis SL, Schaie KW. Cognitive training and plasticity: theoretical perspective and methodological consequences. *Restor Neurol Neurosci* 2009;27:375–89. https://doi.org/10.3233/RNN-2009-0527.
11. Simonet M, von Roten FC, Spierer L et al. Executive control training does not generalize, even when associated with plastic changes in domain-general prefrontal areas. NeuroImage 2019;197:457–69. https://doi.org/10.1016/j.neuroimage.2019.04.010.
12. Fox MD, Raichle ME. Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging. *Nat Rev Neurosci* 2007;8:700–11. https://doi.org/10.1038/nrn2201.
13. Laird AR, Fox PM, Eickhoff SB et al. Behavioral interpretations of intrinsic connectivity networks. *J Cogn Neurosci* 2011;23:4022–37. https://doi.org/10.1162/jocn_a_00077.
14. Seeley WW, Menon V, Schatzberg AF et al. Dissociable intrinsic connectivity networks for salience processing and executive control. *J Neurosci* 2007;27:2349–56. https://doi.org/10.1523/JNEUROSCI.5587-06.2007.
15. Sporns O. Network attributes for segregation and integration in the human brain. *Curr Opin Neurobiol* 2013;23:162–71. https://doi.org/10.1016/j.conb.2012.11.015.
16. Mahon BZ, Cantlon JF. The specialization of functions: cognitive and neural perspectives. *Cogn Neuropsychol* 2011;28:147–55. https://doi.org/10.1080/02643294.2011.633504.
17. Meunier D, Lambiotte R, Fornito A. et al. Hierarchical modularity in human brain functional networks. *Front Neuroinform* 2009;3:37.
18. Bertolero MA, Yeo BT, D'Esposito M. The modular and integrative functional architecture of the human brain. *Proc Natl Acad Sci* 2015;112:E6798–807. https://doi.org/10.1073/pnas.1510619112.
19. Chan MY, Park DC, Savalia NK et al. Decreased segregation of brain systems across the healthy adult lifespan. *Proc Natl Acad Sci* 2014;111:E4997–5006. https://doi.org/10.1073/pnas.1415122111.
20. Betzel RF, Byrge L, He Y et al. Changes in structural and functional connectivity among resting-state networks across the human lifespan. Neuroimage 2014;102:345–57. https://doi.org/10.1016/j.neuroimage.2014.07.067.
21. Ng KK, Lo JC, Lim JKW et al. Reduced functional segregation between the default mode network and the executive control network in healthy older adults: a longitudinal study. Neuroimage 2016;13:321–30. https://doi.org/10.1016/j.neuroimage.2016.03.029.
22. Chong JSX, Ng KK, Tandi J *et al*. Longitudinal changes in the cerebral cortex functional organization of healthy elderly. *J Neurosci* 2019;39:5534–50. https://doi.org/10.1523/JNEUROSCI.1451-18.2019.
23. Hausman HK, O’Shea A, Kraft JN *et al*. The role of resting-state network functional connectivity in cognitive aging. *Front Aging Neurosci* 2020;12:177. https://doi.org/10.3389/fnagi.2020.00177.
24. Bagarina E, Watanabe H, Maesawa S *et al*. Reorganization of brain networks and its association with general cognitive performance over the adult lifespan. *Sci Rep* 2019;9:1–15. https://doi.org/10.1038/s41598-019-47922-x.
25. Bullmore E, Sporns O. Complex brain networks: graph theoretical analysis of structural and functional systems. *Nat Rev Neurosci* 2009;10:186–98. https://doi.org/10.1038/nrn2575.
26. Morris JC. The clinical dementia rating (cdr): current version and. Young 1991;41:1588–92.
27. Folstein MF, Folstein SE, McHugh PR. "Mini-mental state": a practical method for grading the cognitive state of patients for the clinician. *J Psychiatr Res* 1975;12:189–98. https://doi.org/10.1016/0022-3956(75)90026-6.
28. Sheikh JJ, Yesavage JA. Geriatric depression scale (GDS): recent evidence and development of a shorter version. *Clinical gerontologist: the journal of. Aging Ment Health* 1986;5:165–73.
29. Lim CG, Lee TS, Guan C *et al*. A brain-computer interface based attention training program for treating attention deficit hyperactivity disorder. *PloS One* 2012;7:e46692. https://doi.org/10.1371/journal.pone.0046692.
30. Loughlan AR, Braun SE, Lanoye A. Repeatable battery for the assessment of neuropsychological status (RBANS): preliminary utility in adult neuro-oncology. *Neuro-oncol Pract* 2019;6:289–96. https://doi.org/10.1093/nop/npy050.
31. Moradi AR, Doost HTN, Taghavi MR *et al*. Everyday memory deficits in children and adolescents with PTSD: performance on the Rivermead behavioural memory test. *J Child Psychol Psychiatry Allied Discip* 1999;40:357–61. https://doi.org/10.1111/1469-7610.00453.
32. Qian X, Loo BRY, Castellanos FX *et al*. Brain-computer-interface-based intervention re-normalizes brain functional network topology in children with attention deficit/hyperactivity disorder. *Transl Psychiatry* 2018;8:1–11. https://doi.org/10.1038/s41398-018-0213-8.
33. Thomas Yeo B, Krienen FM, Sepulcre J *et al*. The organization of the human cerebral cortex estimated by intrinsic functional connectivity. *J Neurophysiol* 2011;106:1125–65. https://doi.org/10.1152/jn.00338.2011.
34. Guimera R, Amaral LAN. Functional cartography of complex metabolic networks. Nature 2005;433:895–900. https://doi.org/10.1038/nature03288.
35. Lancichinetti A, Fortunato S. Consensus clustering in complex networks. *Sci Rep* 2012;2:1–7. https://doi.org/10.1038/srep00336.
36. Ng ASL, Wang J, Ng KK *et al*. Distinct network topology in Alzheimer's disease and behavioral variant frontotemporal dementia. *Alzheimer's Res Ther* 2021;13:1–16. https://doi.org/10.1186/s13195-020-00752-w.
37. Blondel VD, Guillaume J-L, Lambiotte R *et al*. Fast unfolding of communities in large networks. *J Stat Mech Theory Exp* 2008;2008:P10008. https://doi.org/10.1088/1742-5468/2008/10/P10008.
38. Yang Z, Cieri F, Kinney JW *et al*. Brain functional topology differs by sex in cognitively normal older adults. *Cereb Cortex Commun* 2022;3:tgac023. https://doi.org/10.1093/texcom/tgac023.
39. Du Y, Yuan Z, Sui J *et al*. Common and unique brain aging patterns between females and males quantified by large-scale deep learning. *Hum Brain Mapp* 2024;45:e70005. https://doi.org/10.1002/hbm.70005.
40. Liang X, Zou Q, He Y *et al*. Topologically reorganized connectivity architecture of default-mode, executive-control, and salience networks across working memory task loads. *Cereb Cortex* 2016;26:1501–11. https://doi.org/10.1093/cercor/bhu316.
41. Murphy AC, Bertolero MA, Papadopoulos L *et al*. Multimodal network dynamics underpinning working memory. *Nat Commun* 2020;11:1–13. https://doi.org/10.1038/s41467-020-15541-0.
42. Kelly AC, Uddin LQ, Biswal BB *et al*. Competition between functional brain networks mediates behavioral variability. Neuroimage 2008;39:527–37. https://doi.org/10.1016/j.neuroimage.2007.08.008.
43. Geerligs L, Maurits NM, Renken RJ *et al*. Reduced specificity of functional connectivity in the aging brain during task performance. *Hum Brain Mapp* 2014;35:319–30. https://doi.org/10.1002/hbm.22175.
44. Fjell AM, Sheve MH, Grydeland H *et al*. The disconnected brain and executive function decline in aging. *Cereb Cortex* 2017;27:2303–17. https://doi.org/10.1093/cercor/bhw082.
45. Yao F, Zhao Z, Wang Y *et al*. Age-related differences of the time-varying features in the brain functional connectivity and cognitive aging. Psychophysiology 2025;62:e14702. https://doi.org/10.1111/psyp.14702.
46. Damoiseaux JS. Effects of aging on functional and structural brain connectivity. Neuroimage 2017;160:32–40. https://doi.org/10.1016/j.neuroimage.2017.01.077.
47. Oschwald J, Guye S, Liem F *et al*. Brain structure and cognitive ability in healthy aging: a review on longitudinal correlated change. *Rev Neurosci* 2019;31:1–57. https://doi.org/10.1515/revneuro-2018-0096.
48. David O, Maess B, Eckstein K *et al*. Dynamic causal modeling of subcortical connectivity of language. *J Neurosci* 2011;31:2712–7. https://doi.org/10.1523/JNEUROSCI.3433-10.2011.
49. Ji JL, Spronk M, Kulkarni K *et al*. Mapping the human brain's cortical-subcortical functional network organization. Neuroimage 2019;185:35–57. https://doi.org/10.1016/j.neuroimage.2018.10.006.
50. Zhang L, Hu J, Liu X *et al*. Disrupted subcortical-cortical connections in a phonological but not semantic task in Chinese children with dyslexia. *Front Hum Neurosci* 2020;14:618.
51. Krishnan S, Watkins KE, Bishop DV. Neurobiological basis of language learning difficulties. *Trends Cogn Sci* 2016;20:701–14. https://doi.org/10.1016/j.tics.2016.06.012.
52. Ketteler D, Kastrau F, Vohn R *et al*. The subcortical role of language processing. High level linguistic features such as ambiguity-resolution and the human brain; an fMRI study. NeuroImage 2008;39:2002–9. https://doi.org/10.1016/j.neuroimage.2007.10.023.
53. Onoda K, Yamaguchi S. Small-worldness and modularity of the resting-state functional brain network decrease with aging. *Neurosci Lett* 2013;556:104–8. https://doi.org/10.1016/j.neulet.2013.10.023.
54. Baldwin CL, Greenwood PM, *Cognitive and Brain Aging: Interventions to Promote Well-Being in Old Age*. 2020, Frontiers in Aging Neuroscience, 353, Vol. 11, https://doi.org/10.3389/fnagi.2019.00353.
55. Requena C, Turrero A, Ortiz T. Six-year training improves everyday memory in healthy older people. Randomized controlled trial. *Front Aging Neurosci* 2016;8:135.
56. Grönholm-Nyman P, Soveri A PhD, Rinne JO MD *et al.* Limited effects of set shifting training in healthy older adults. *Front Aging Neurosci* 2017;9:69. https://doi.org/10.3389/fnagi.2017.00069.
57. Ewers M, Luan Y, Frontzkowski L *et al.* Segregation of functional networks is associated with cognitive resilience in Alzheimer’s disease. Brain 2021;144:2176–85. https://doi.org/10.1093/brain/awab112.
58. Deery HA, di Paolo R, Moran C *et al.* The older adult brain is less modular, more integrated, and less efficient at rest: a systematic review of large-scale resting-state functional brain networks in aging. Psychophysiology 2023;60:e14159. https://doi.org/10.1111/psyp.14159.
59. Khan AF, Saleh N, Smith ZA. The brain’s aging resting state functional connectivity. *J Integr Neurosci* 2025;24:25041. https://doi.org/10.31083/JIN25041.

文献链接:https://academic.oup.com/ageing/article/54/9/afaf250/8252877
文献 DOI:https://doi.org/10.1093/ageing/afaf250
脑机接口产业联盟作为脑机接口的合作与促进平台,着力聚集产业界各方资源,共同致力于推进脑机接口产业发展、需求与架构、标准、产品、解决方案及应用推广,形成良好的合作氛围及协作机制,围绕产业链,协调组织关键问题研究和核心技术攻关,促进产业生态繁荣,为中国及全球脑机接口产业发展提供必要支撑。
加入方式
关注脑机接口产业联盟公众号,菜单栏获取联盟加入申请表格,材料齐全后发秘书处。
欢迎业界积极参与联络,联系邮箱:bcia@caict.ac.cn。

(扫码获取加入联盟的申请材料)